皮肤病空转案例:瘢痕疙瘩单细胞和空间转录组学综合分析文献解读
信息来源:金开瑞 作者:genecreate 发布时间:2022-07-27 13:56:27
前言
瘢痕疙瘩是机体皮肤受到创伤后,在修复过程中由于真皮成纤维细胞过度增生和过剩的细胞外基质沉积尤其是以胶原沉积和排列紊乱为特征的一种病理性瘢痕,主要表现为高出正常皮肤表面、超出原始损伤范围、呈持续性生长的肿块,质地较硬,弹性较差,伴有瘙痒或疼痛。单细胞测序技术加强了研究者对瘢痕疙瘩以及其他纤维化疾病的了解,然而这些研究主要集中在成纤维细胞(Fibroblast,FB)的细胞异质性上。为了解析瘢痕疙瘩的发病机制,需要更加全面理解皮肤中其他细胞的分子特征,如血管内皮细胞(Endothelium Cell,EC)。2022年2月在The Journal of Investigative Dermatology上发表的Integrated analysis of single-cell and spatial transcriptomics in keloids: Highlights on fibro-vascular interactions in keloid pathogenesis 一文中(IF:8.55),首尔成均馆大学医学院Lee JongHee团队使用单细胞RNA测序(scRNA-seq)和空间转录组(Spatial Transcriptomics,ST)两种技术揭示了瘢痕疙瘩潜在的病理机制。
单细胞转录组测序
作者在两名患者(#1#3)的瘢痕疙瘩中心区域通过组织活检取样,并对#3患者的成熟疤痕进行取样,之后进行单细胞转录组测序。利用已发表的一组五人正常皮肤样本的单细胞转录组数据,用以表征瘢痕疙瘩的异质性。对于两个瘢痕疙瘩样本和五个正常皮肤样本使用无监督聚类,即不依靠marker基因进行分类,得到31个细胞簇。再依据源于差异表达基因(DEG)分析的细胞特异性标记将31个簇分为了15个已知的细胞谱系(图1 d)。

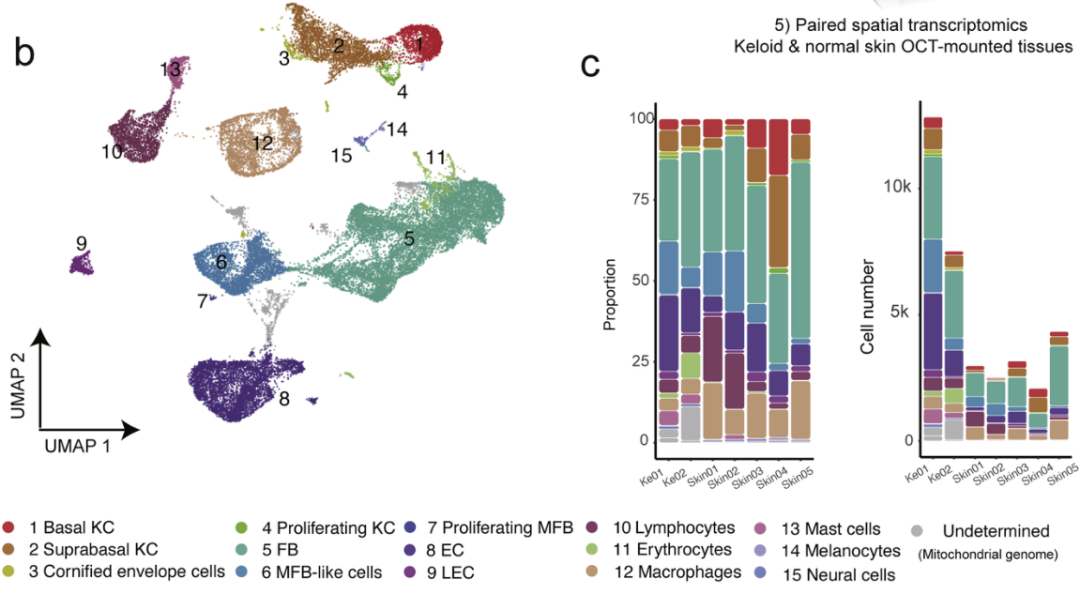

疾病相关成纤维细胞亚群
作者为了确定瘢痕疙瘩中FB的异质性,对11562个细胞成纤维细胞重新聚类,区分出7个FB亚群,其中4个亚群由已报道研究中的marker基因确定:FB3(间充质FB)、FB5(分泌性乳头状FB)、FB6(分泌网状FB)和FB7(促炎FB)。再根据瘢痕疙瘩与正常皮肤的比例进一步定义了FB1、FB2和FB4(图2 b)。FB1和FB2簇由来自瘢痕疙瘩病变的90.5%细胞组成,而FB4簇由来自正常皮肤的87.3%细胞组成。为确定瘢痕疙瘩和正常皮肤FB内的细胞状态差异,作者进行了细胞轨迹分析,指定富含正常皮肤的FB4簇为“开始状态”,分析显示FB1或FB2(富含瘢痕疙瘩的簇)是“终端状态”,并标注簇从正常皮肤FB分化到瘢痕疙瘩FB的途径。再对比了FB4和FB1、FB2之间的DEG并进行GO富集分析(图2 f)。
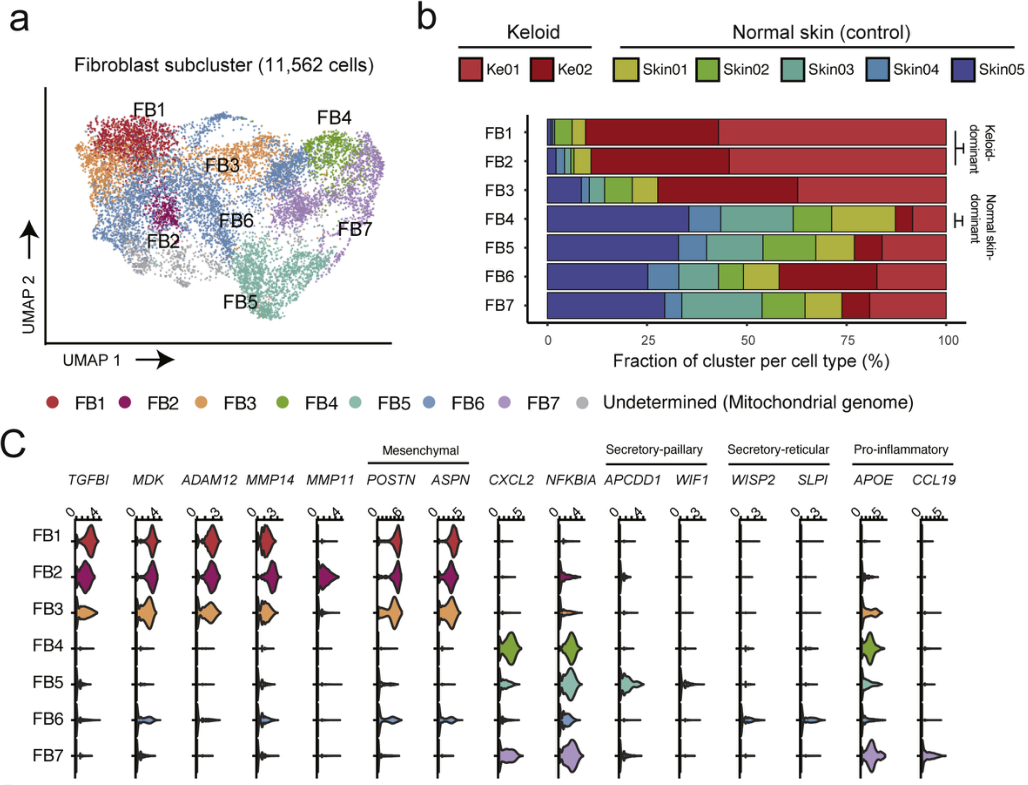
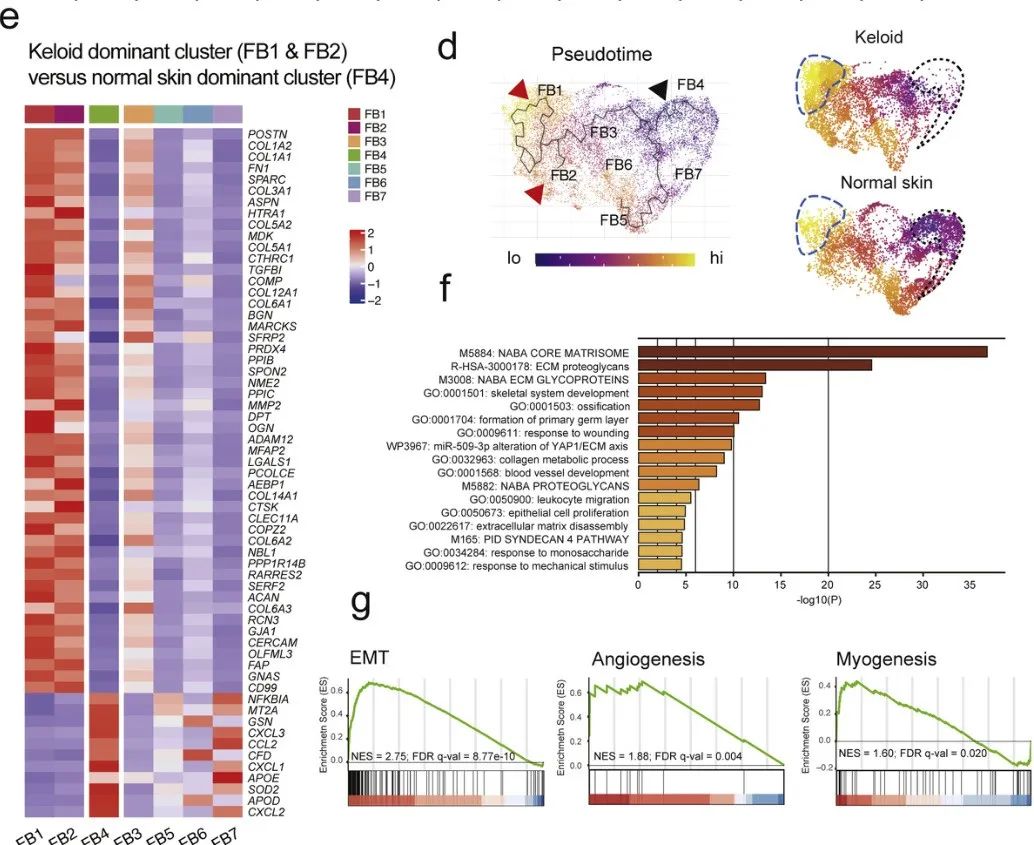 图 2 瘢痕疙瘩和正常皮肤FB的聚类揭示了瘢痕疙瘩的基质异质性
图 2 瘢痕疙瘩和正常皮肤FB的聚类揭示了瘢痕疙瘩的基质异质性
(a) FB亚类的 UMAP 投影。(b)FB亚群中每个亚细胞状态的组织起源的相对比例。(c)小提琴图代表 FB 亚群中一组明显表达的基因。(d)左:拟时序分析显示FB谱系从FB4“起始状态”(黑色箭头)到“终止状态”(红色箭头)的分化途 径。右图:突出显示“起始状态”和“终止状态”的划分的伪时序细胞排序。拟时序被描绘为紫色到黄色。(e)瘢痕疙瘩FB中差异表达基因的聚类热图。(f)在瘢痕疙瘩 FBs 中上调基因的GO富集分析。(g)瘢痕疙瘩FB的代表性GSEA途径。FB,成纤维细胞;EMT,上皮间质转化。
整合空间转录组数据
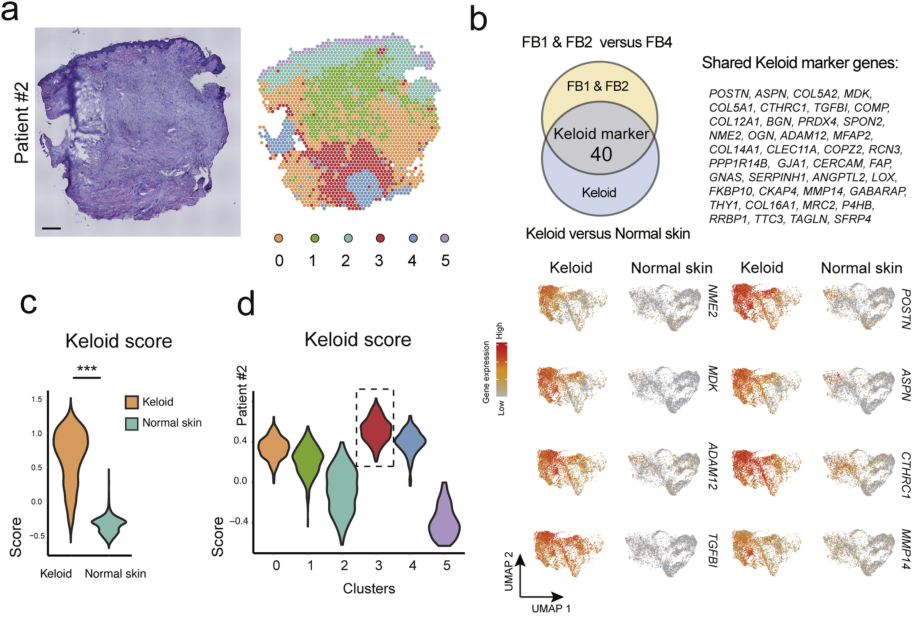
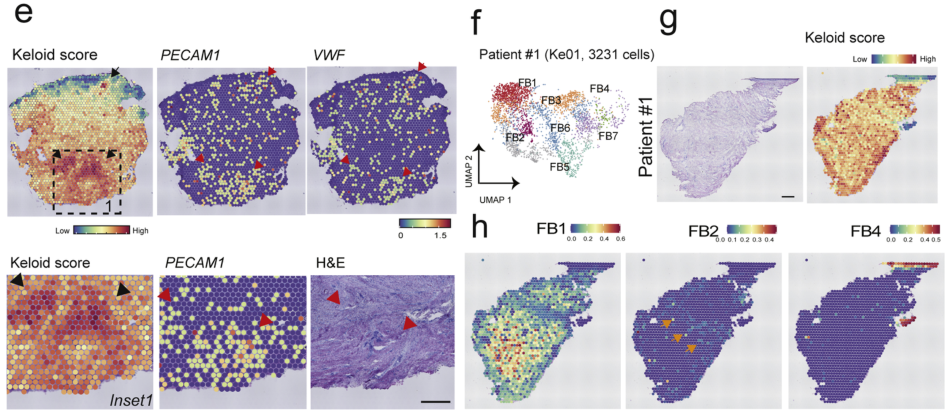
为了进一步评估瘢痕疙瘩组织以及FB的空间异质性,作者对两名患者(#1#2)的瘢痕组织样本以及两个正常人的皮肤切片进行空间转录组分析。首先根据瘢痕疙瘩marker基因转录水平进行瘢痕疙瘩评分,以定位组织中活跃的瘢痕疙瘩位点。作者方向高评分位点确实特异性定位在瘢痕疙瘩部位,病变程度深的位点评分更高,并且高评分位点主要位于内皮转录本周围,这突出了纤维血管生态位在病变机制中的潜在作用。
瘢痕疙瘩内皮细胞的间充质激活
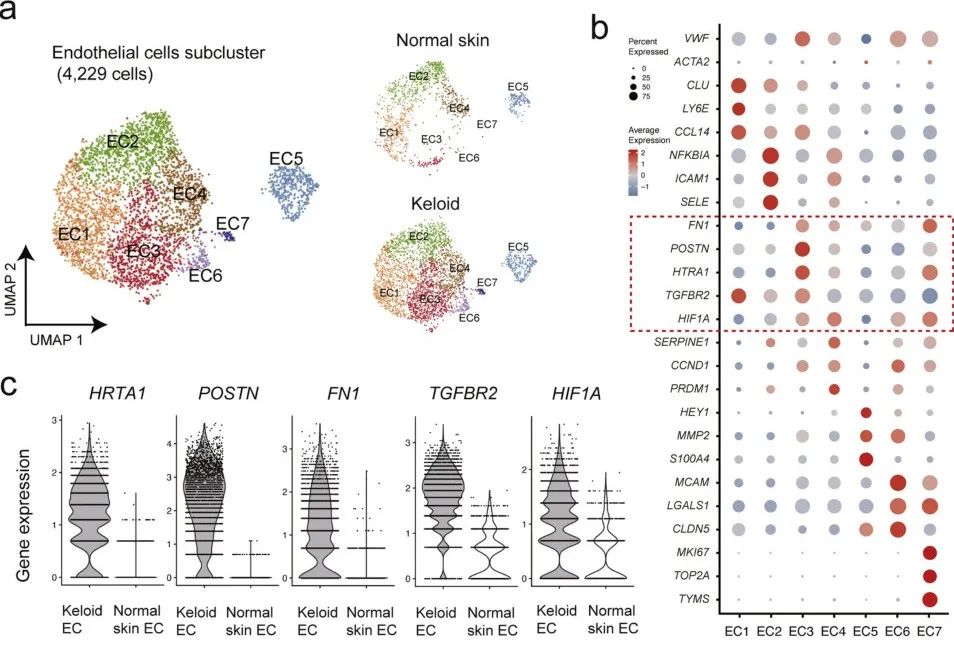
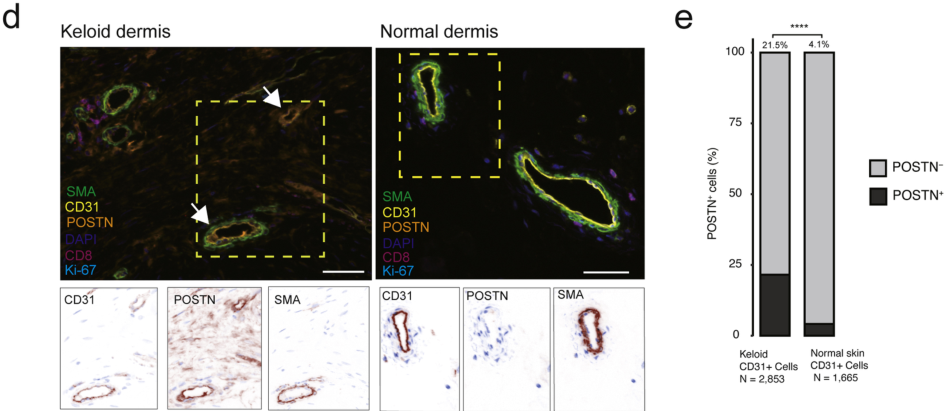
由于EC和FB有密切的互作,作者对EC进行聚类并解析细胞异质性,对scRNA-seq数据进行无监督分析,得到七个亚类(EC1-EC7)。其中,EC3簇90.3%由来自瘢痕疙瘩样本的细胞组成,并有独特的表达谱。这样的表达谱类似于伤口愈合时间充质激活过程。与正常皮肤EC相比,这些特征基因也在瘢痕疙瘩的EC亚群特异性表达。为进一步证明瘢痕疙瘩中发生间充质激活,作者进行了mIF,观察到疙瘩标记基因中POSTN与血管标志物CD31共定位。
空间转录组验证瘢痕疙瘩中潜在的细胞互作
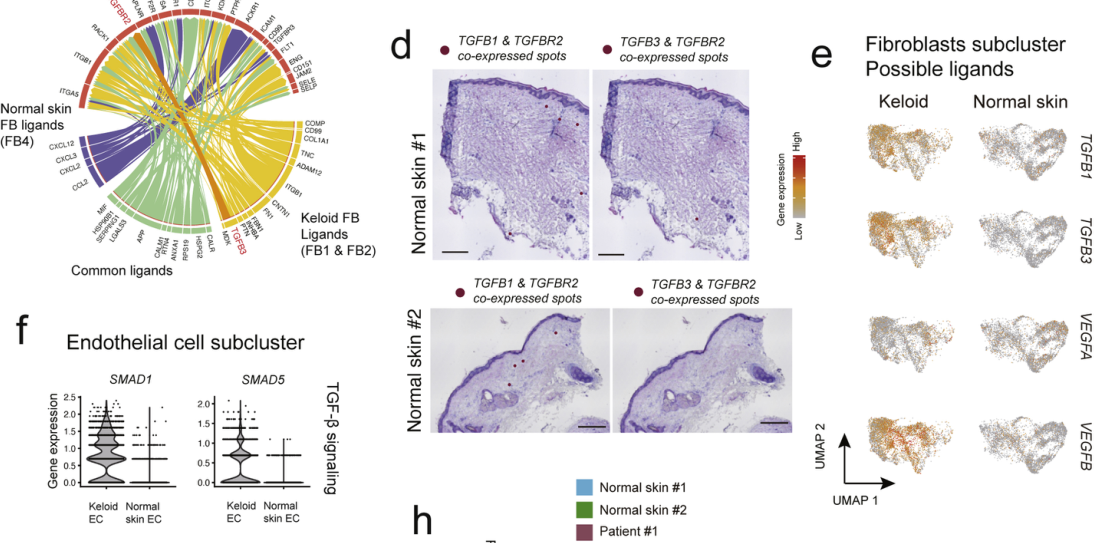
作者进行了细胞间互作分析,发现在瘢痕疙瘩EC中观察到更多相互作用(图5 a),其中有已知重要的TGFB3-TGFBR2通路,能够促进EC增殖与迁移。分析预测了瘢痕疙瘩EC通过与间充质激活相关配体来调节瘢痕疙瘩FB,并且瘢痕疙瘩中TGF-β信号传导互作发生显著改变。
为了验证预测的互作,作者将配体-受体对的表达映射在空间转录组切片上,发现了TGFB1-TGFBR2以及TGFB3-TGFBR2大量共定位(图5b-c)。而瘢痕疙瘩EC中SMAD1和SMAD5的高表达证明了TGF-β信号传导的激活(图5 f),并且TGF-β配体-受体共定位的位点在瘢痕疙瘩中显著富集(图5 d)。这验证了失调的TGF-β/SMAD信号会通过促进血管形成以刺激异常纤维化以促进瘢痕疙瘩形成。

作者对比了从#3患者获得的成熟疤痕单细胞转录谱,发现了瘢痕疙瘩中表达POSTN、ADAM12和TGFBI的FB亚群比例更高,而且瘢痕疙瘩EC的间充质激活现象更加显著。这可以作为瘢痕疙瘩的一个关键特征。


总结
作者以单细胞分辨率描绘了瘢痕疙瘩的细胞景观,通过scRNA-seq分析可以将FB分成7个亚群,证实了表达POSTN、ADAM12、TGFBI的FB亚群的异质性,并在纤维化皮肤病中起重要作用。将scRNA-seq分析出的瘢痕疙瘩标记基因映射到瘢痕疙瘩空间转录组切片上,发现瘢痕疙瘩评分高的位点主要位于血管周围,说明纤维血管相互作用可能在病程发展中起重要作用。由于瘢痕疙瘩EC在转录上与组织缺血或伤口愈合过程中EC间充质激活类似,说明瘢痕疙瘩EC的间充质激活可能与新生血管形成有关,并促进了瘢痕疙瘩发展。作者根据空间转录组对配体-受体互相作用进行精细定位,发现了过表达的TGF-β/SMAD信号会通过促进血管形成以刺激异常纤维化以促进瘢痕疙瘩形成。虽然此研究没有与患者匹配正常皮肤的对照,但研究了患者匹配成熟正常疤痕,同样发现了FB细胞的异质性以及EC间充质激活差异。
参考文献
Shim J, Oh SJ, Yeo E, et al. Integrated analysis of single-cell and spatial transcriptomics in keloids: Highlights on fibro-vascular interactions in keloid pathogenesis [published online ahead of print, 2022 Feb 3]. J Invest Dermatol. 2022;S0022-202X(22)00085-9. doi:10.1016/j.jid.2022.01.017
瘢痕疙瘩是机体皮肤受到创伤后,在修复过程中由于真皮成纤维细胞过度增生和过剩的细胞外基质沉积尤其是以胶原沉积和排列紊乱为特征的一种病理性瘢痕,主要表现为高出正常皮肤表面、超出原始损伤范围、呈持续性生长的肿块,质地较硬,弹性较差,伴有瘙痒或疼痛。单细胞测序技术加强了研究者对瘢痕疙瘩以及其他纤维化疾病的了解,然而这些研究主要集中在成纤维细胞(Fibroblast,FB)的细胞异质性上。为了解析瘢痕疙瘩的发病机制,需要更加全面理解皮肤中其他细胞的分子特征,如血管内皮细胞(Endothelium Cell,EC)。2022年2月在The Journal of Investigative Dermatology上发表的Integrated analysis of single-cell and spatial transcriptomics in keloids: Highlights on fibro-vascular interactions in keloid pathogenesis 一文中(IF:8.55),首尔成均馆大学医学院Lee JongHee团队使用单细胞RNA测序(scRNA-seq)和空间转录组(Spatial Transcriptomics,ST)两种技术揭示了瘢痕疙瘩潜在的病理机制。
单细胞转录组测序
作者在两名患者(#1#3)的瘢痕疙瘩中心区域通过组织活检取样,并对#3患者的成熟疤痕进行取样,之后进行单细胞转录组测序。利用已发表的一组五人正常皮肤样本的单细胞转录组数据,用以表征瘢痕疙瘩的异质性。对于两个瘢痕疙瘩样本和五个正常皮肤样本使用无监督聚类,即不依靠marker基因进行分类,得到31个细胞簇。再依据源于差异表达基因(DEG)分析的细胞特异性标记将31个簇分为了15个已知的细胞谱系(图1 d)。



图 1人类瘢痕疙瘩单细胞和空间转录组图谱的生成
疾病相关成纤维细胞亚群
作者为了确定瘢痕疙瘩中FB的异质性,对11562个细胞成纤维细胞重新聚类,区分出7个FB亚群,其中4个亚群由已报道研究中的marker基因确定:FB3(间充质FB)、FB5(分泌性乳头状FB)、FB6(分泌网状FB)和FB7(促炎FB)。再根据瘢痕疙瘩与正常皮肤的比例进一步定义了FB1、FB2和FB4(图2 b)。FB1和FB2簇由来自瘢痕疙瘩病变的90.5%细胞组成,而FB4簇由来自正常皮肤的87.3%细胞组成。为确定瘢痕疙瘩和正常皮肤FB内的细胞状态差异,作者进行了细胞轨迹分析,指定富含正常皮肤的FB4簇为“开始状态”,分析显示FB1或FB2(富含瘢痕疙瘩的簇)是“终端状态”,并标注簇从正常皮肤FB分化到瘢痕疙瘩FB的途径。再对比了FB4和FB1、FB2之间的DEG并进行GO富集分析(图2 f)。


(a) FB亚类的 UMAP 投影。(b)FB亚群中每个亚细胞状态的组织起源的相对比例。(c)小提琴图代表 FB 亚群中一组明显表达的基因。(d)左:拟时序分析显示FB谱系从FB4“起始状态”(黑色箭头)到“终止状态”(红色箭头)的分化途 径。右图:突出显示“起始状态”和“终止状态”的划分的伪时序细胞排序。拟时序被描绘为紫色到黄色。(e)瘢痕疙瘩FB中差异表达基因的聚类热图。(f)在瘢痕疙瘩 FBs 中上调基因的GO富集分析。(g)瘢痕疙瘩FB的代表性GSEA途径。FB,成纤维细胞;EMT,上皮间质转化。
整合空间转录组数据
为了进一步评估瘢痕疙瘩组织以及FB的空间异质性,作者对两名患者(#1#2)的瘢痕组织样本以及两个正常人的皮肤切片进行空间转录组分析。首先根据瘢痕疙瘩marker基因转录水平进行瘢痕疙瘩评分,以定位组织中活跃的瘢痕疙瘩位点。作者方向高评分位点确实特异性定位在瘢痕疙瘩部位,病变程度深的位点评分更高,并且高评分位点主要位于内皮转录本周围,这突出了纤维血管生态位在病变机制中的潜在作用。


图 3 瘢痕疙瘩基质细胞的空间结构
(a) ST载玻片的H&E染色和患者#2中ST位点的无偏聚类。(b)显示共享瘢痕疙瘩标记基因的维恩图和特征图。(c-d)小提琴图描绘了样本来源(c)和ST点簇(d)的瘢痕疙瘩评分。(e)描绘瘢痕疙瘩评分(黑色箭头)和内皮转录本(红色箭头)的空间图。(f)患者#1的UMAP 图。(g-h)瘢痕疙瘩评分(g)和细胞类型预测评分(h)覆盖在 H&E 图像上。富集 FB2 簇(橙色箭头)的点,表达MMP11和MMP14,分布在富集 FB1 点的前缘。比例尺 = 0.5 mm。瘢痕疙瘩内皮细胞的间充质激活
由于EC和FB有密切的互作,作者对EC进行聚类并解析细胞异质性,对scRNA-seq数据进行无监督分析,得到七个亚类(EC1-EC7)。其中,EC3簇90.3%由来自瘢痕疙瘩样本的细胞组成,并有独特的表达谱。这样的表达谱类似于伤口愈合时间充质激活过程。与正常皮肤EC相比,这些特征基因也在瘢痕疙瘩的EC亚群特异性表达。为进一步证明瘢痕疙瘩中发生间充质激活,作者进行了mIF,观察到疙瘩标记基因中POSTN与血管标志物CD31共定位。


图 4 瘢痕疙瘩内皮细胞的间充质激活
(a)EC亚群的UMAP投影。与正常皮肤EC相比,瘢痕疙瘩EC中的EC3亚群显着增加。(b)显示选定标记基因表达的点图。(c)小提琴图显示了瘢痕疙瘩EC和正常EC之间EC3的五个代表性基因的表达。(d)瘢痕疙瘩真皮和正常真皮代表性切片中CD31、POSTN、α-SMA、CD8和Ki-67的mIF染色。箭头表示瘢痕疙瘩EC的间充质激活。(e)跨52个ROI的POSTN/CD31双阳性细胞的定量;分别来自CD31的2,853个细胞和1,665个细胞瘢痕疙瘩细胞和CD31正常皮肤细胞。比例尺=0.05mm。空间转录组验证瘢痕疙瘩中潜在的细胞互作
作者进行了细胞间互作分析,发现在瘢痕疙瘩EC中观察到更多相互作用(图5 a),其中有已知重要的TGFB3-TGFBR2通路,能够促进EC增殖与迁移。分析预测了瘢痕疙瘩EC通过与间充质激活相关配体来调节瘢痕疙瘩FB,并且瘢痕疙瘩中TGF-β信号传导互作发生显著改变。
为了验证预测的互作,作者将配体-受体对的表达映射在空间转录组切片上,发现了TGFB1-TGFBR2以及TGFB3-TGFBR2大量共定位(图5b-c)。而瘢痕疙瘩EC中SMAD1和SMAD5的高表达证明了TGF-β信号传导的激活(图5 f),并且TGF-β配体-受体共定位的位点在瘢痕疙瘩中显著富集(图5 d)。这验证了失调的TGF-β/SMAD信号会通过促进血管形成以刺激异常纤维化以促进瘢痕疙瘩形成。



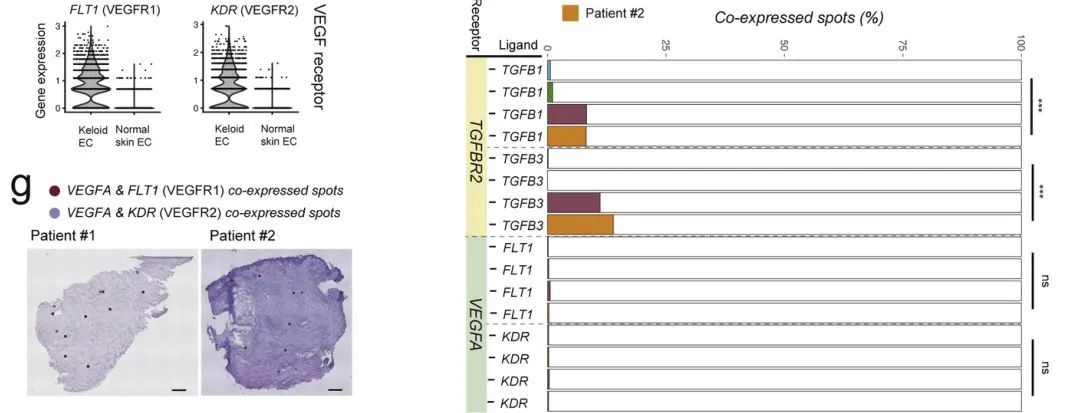
图 5 绘制瘢痕疙瘩中潜在的细胞相互作用。
(a)描绘FB和EC亚群之间的细胞间互作的Circos图。橙线表示TGFB3-TGFBR2互作。(b-d)TGFB1-TGFBR2和TGFB3-TGFBR2互作的共定位覆盖在ST部分上。(e)特征图显示与瘢痕疙瘩FB和正常FB中的新血管形成相关的潜在的配体表达差异。(f)TGF-β信号(SMAD1和SMAD5)和VEGF受体(FLT1和KDR)的小提琴图分别在瘢痕疙瘩EC和正常EC上的表达。(g)ST载玻片中VEGFA-FLT1和VEGFA-KDR互作的共定位。(h)条形图分别描绘了瘢痕疙瘩和正常皮肤切片中受体-配体共表达斑点的百分比。比例尺=0.5毫米。作者对比了从#3患者获得的成熟疤痕单细胞转录谱,发现了瘢痕疙瘩中表达POSTN、ADAM12和TGFBI的FB亚群比例更高,而且瘢痕疙瘩EC的间充质激活现象更加显著。这可以作为瘢痕疙瘩的一个关键特征。


图 6瘢痕疙瘩和成熟疤痕的患者匹配分析,以确认瘢痕疙瘩的转录组学特征。
(a)瘢痕疙瘩(Ke02)和成熟疤痕(MS02)的临床照片。(b)患者#3切片的H&E染色。(c)患者匹配样本单细胞转录组的FB亚群的UMAP图。(d)小提琴图代表FB亚群中的一组标记基因。(e)将瘢痕疙瘩评分投影在FB亚群的UMAP图上。(f)左:瘢痕疙瘩和成熟疤痕FB亚群中四个FB亚群的相对比例。右图:四个FB亚群中细胞的瘢痕疙瘩评分。(G)显示EC亚群的选定血管标记基因表达的点图。FB,成纤维细胞;EC,内皮细胞。比例尺=0.1mm。总结
作者以单细胞分辨率描绘了瘢痕疙瘩的细胞景观,通过scRNA-seq分析可以将FB分成7个亚群,证实了表达POSTN、ADAM12、TGFBI的FB亚群的异质性,并在纤维化皮肤病中起重要作用。将scRNA-seq分析出的瘢痕疙瘩标记基因映射到瘢痕疙瘩空间转录组切片上,发现瘢痕疙瘩评分高的位点主要位于血管周围,说明纤维血管相互作用可能在病程发展中起重要作用。由于瘢痕疙瘩EC在转录上与组织缺血或伤口愈合过程中EC间充质激活类似,说明瘢痕疙瘩EC的间充质激活可能与新生血管形成有关,并促进了瘢痕疙瘩发展。作者根据空间转录组对配体-受体互相作用进行精细定位,发现了过表达的TGF-β/SMAD信号会通过促进血管形成以刺激异常纤维化以促进瘢痕疙瘩形成。虽然此研究没有与患者匹配正常皮肤的对照,但研究了患者匹配成熟正常疤痕,同样发现了FB细胞的异质性以及EC间充质激活差异。

图 7 全文内容归纳
研究FB细胞异质性和EC-FB配体-受体对空间位置涉及到空间转录组。参考文献
Shim J, Oh SJ, Yeo E, et al. Integrated analysis of single-cell and spatial transcriptomics in keloids: Highlights on fibro-vascular interactions in keloid pathogenesis [published online ahead of print, 2022 Feb 3]. J Invest Dermatol. 2022;S0022-202X(22)00085-9. doi:10.1016/j.jid.2022.01.017
最新动态
-
04.22
一文读懂EMSA技术核心要点,让“emsa” 秒变“easy”
-
04.02
4·2世界孤独症日 | 聆听“星”声“泌”语,让爱来,让碍走
-
04.01
酵母杂交核心技术:深度Q&A帮你轻松突破实验瓶颈
-
03.19
【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
-
03.18
siRNA介绍及药物研发的现状前景
-
03.18
知无不“研”|5篇高分文献带你一览高通量酵母杂交的非凡魅力~
-
02.27
【客户文章分享】SHMT2 通过 5′UTR 依赖性 ADAM10 翻译启动介导小分子诱导的阿尔茨海默病病理学缓解过程
-
01.24
客户文献解读 | 中医为什么能治流感?是玄学还是运气?INT J NANOMED揭示鱼腥草抗病毒机制及范围!
-
01.24
客户文献分享,IF>11|Shank3:脑缺血再灌注损伤的守护者,揭示神经保护的新篇章
-
12.27
文献解读 | 高密度脂蛋白通过miR-181a-5p调控自噬影响血管新生










