分子互作研究
- 核酸-核酸互作
- 核酸-蛋白互作
- 蛋白-蛋白互作
服务特色
金开瑞多年来致力于分子互作机制研究,组建了专门的分子互作研究技术团队,拥有丰富的互作类项目设计、实施经验,可以为您提供核酸与核酸、核酸与蛋白、蛋白与蛋白间等各类从方案流程设计到技术实施的整套互作研究服务。
服务介绍
分子、细胞、个体水平上的机制研究、功能研究、表型研究是生物学研究中的热点。分子(核酸与核酸、核酸与蛋白、蛋白与蛋白)互作研究是机制研究的重要组成部分,是功能、表型研究的进一步深化。随着人类基因组计划的完成,后基因组时代的深入,测序、质谱、生物信息联合分析等技术的进一步发展,使得高通量筛选生物标记物、寻找生物关联分子变得可能,同时对分子互作技术的应用提出了更高的要求。
服务类型
文档下载
常见问题
(1)酵母双杂交系统主要用于研究蛋白和蛋白之间的互作。 (2)酵母单杂交系统主要用于研究DNA和蛋白之间的互作。
1.从文库构建来说: (1) 文库构建方式灵活:根据样本的类型,提供的样本量等方面考虑,可采用smart,geteway,infusion体外重组和T4体外连接等方式进行文库构建; (2) 文库片段大小可控:根据客户想要研究的蛋白类型大小控制片段的大小,以提高筛选到目标蛋白的可能性。如白细胞介素,生长因子类的小分子蛋白;转录因子,信号通路类的分子量稍大一些的蛋白; (3) 单双杂文库通用:构建一种类型的文库,可同时用于单双杂筛选; 2.对于文库筛选来说: (1)筛库方式多样:可采用mating或共转的方式进行文库筛选; (2)互作强弱可控化:提高(降低)筛选压力,用于筛选出强(弱)相互作用的蛋白。 (3)阳性结果进一步验证:文库筛选出的阳性结果,可进行点对点验证进一步排除假阳性。
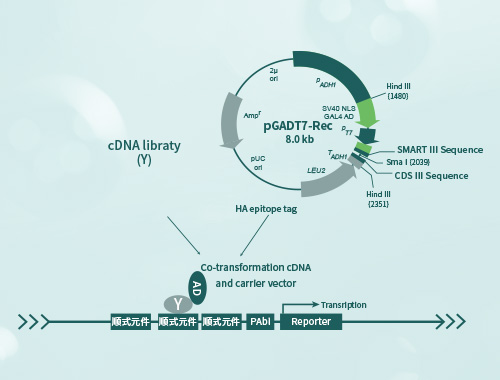
主要业务范围如下: 1.核酵母单/双杂文库构建; 2.膜酵母双杂交文库构建; 3.核酵母单/双杂文库筛选; 4.膜酵母双杂交文库; 5.核酵母单/双杂点对点验证; 6.膜酵母双杂交点对点验证。
(1)HIS3。Y2HGold不能合成组氨酸,因此不能在缺乏这种必需氨基酸的培养基上生长。当诱饵和猎物蛋白质相互作用时,Gal4-responsive His3的表达允许细胞生物合成组氨酸并在其最小的培养基上生长.可添加3’AT进行背景抑制。 (2)ADE2。Y2HGold也不能在不含腺嘌呤的最小培养基上生长。然而,当两种蛋白质相互作用时,Ade2表达被激活,使这些细胞在Ade最小培养基上生长。 (3)MEL1。MEL-1编码-半乳糖苷酶,一种在许多酵母菌中自然存在的酶。由于双杂交相互作用,α-galactosidase (MEL1)由酵母细胞表达和分泌。表达Mel1的酵母菌落在致变色底物X-α-Gal存在下变成蓝色。 (4)AUR1-C,AUR1基因的一个显性突变版本,编码肌醇磷酸化神经酰胺syn- thase酶。AUR1-C在Y2HGold酵母株中表达,是由于蛋白质与蛋白质的相互作用,使GAL4转录激活和DNA结合域接近。可以添加ABA进行背景抑制。, PABAI载体携带Ura3基因,PGADT7载体携带Leu基因,PGBKT7载体携带trp基因, 筛选所用到的平板:一缺:SD/- Ura, SD/- Leu /+AbA ; 二缺:DDO[SD/-Leu/-Trp], DDO/X[SD/-Leu/-Trp/X-α-gal] ; 三缺:TDO [SD/-Leu/-Trp/HIS3]; 四缺:QDO[SD/-Leu/-Trp/-HIS3/-ADE2]
(1)PGBKT7载体用于构建核酵母双杂Bait-PGBKT7质粒或作空白对照。 (2)PGADT7载体用于构建核酵母双杂,单杂Prey-PGADT7质粒或作空白对照。 (3)PABAI 载体用于构建单杂Bait-PABAI质粒。 (4)PGBKT7-53质粒与PGADT7-T质粒作为核酵母双杂验证和筛选的阳性对照组。 (5)PGBKT7-lam质粒与PGADT7-T质粒作为核酵母双杂验证和筛选的阴性对照组 (6)pOST1-NubI 质粒与pBT3-N-bait质粒作为膜酵母双杂交验证和筛选的功能验证对照组; (7)pBT3-N载体用于构建N端位于胞质,C端位于细胞器腔内(或者胞外)诱饵蛋白; (8)pBT3-SUC载体用于构建N端位于细胞器腔内(或者胞外),且N端含有信号肽的诱饵蛋白; (9)pBT3-STE载体用于构建C端位于胞质,N端位于细胞器腔内(或者胞外),且N端不含信号肽的诱饵蛋白; (10)pBT3-N和pBT3-STE皆可N端C端均位于胞质的诱饵蛋白; (11)pPR3-C载体用于C端位于胞质,N端位于胞外或细胞器腔的猎物蛋白构建; (12)PPR3-N载体用于膜文库构建和不跨膜的猎物蛋白构建; (13)Ptsu2-APP质粒和pNubG-Fe65质粒作为膜酵母双杂验证和筛选的阳性对照组; (14)Ptsu2-APP质粒和PPR3-N质粒作为膜酵母双杂验证和筛选的阴性对照组 (15)Y187菌株:Clontech公司开发的GAL4系统酵母单杂,双杂实验用菌株,MATα型,可直接转化质粒或与MATa型酵母菌株(Y2HGold,AH109等)通过mating操作进行筛库试验。缺陷 trp1, leu2,报告基因为:lacZ, MEL1。 (16)Y1HGOLD菌株:Clontech公司开发的GAL4-AbA酵母单杂系统用菌株,MATα型,可直接转化质粒进行筛库试验。缺陷 ura3,leu2;报告基因为:AbAr。 (17)Y2HGold菌株:Clontech公司开发的GAL4系统酵母双杂实验用菌株,MATa型,可直接转化质粒或与MATα型酵母菌株Y187通过mating操作进行蛋白互作验证或筛库试验。Transformation marker为: trp1, leu2,报告基因为:AbAr, HIS3, ADE2, MEL1。 (18)NMY51菌株:DUALsystems BioTech公司开发的检测膜蛋白间相互作用的酵母双杂实验用菌株,可直接转化质粒进行蛋白互作验证或筛库试验;此菌株缺陷 trp1, leu2-3,报告基因为:HIS3, ADE2 和 lacZ
建库:总RNA提取——mRNA分离及纯化——双链cDNA合成及纯化——双链cDNA与PGADT7载体体外连接——大肠文库菌液——文库质粒——转化Y187酵母宿主——Y187酵母文库菌液 双杂筛选:(1)matting方式:诱饵重组质粒PGBKT7载体构建——诱饵重组质粒和PGADT7空载转Y2Hgold酵母宿主进行自激活验证——含诱饵的Y2Hgold酵母菌液与Y187酵母文库菌液进行混合——根据自激活结果涂布筛选平板——阳性结果点钟——阳性菌培养提质粒——PCR阳性鉴定——送测——测序结果分析 (2)共转:诱饵重组质粒PGBKT7载体构建——诱饵重组质粒和PGADT7空载转Y2Hgold酵母宿主进行自激活验证——文库质粒转化含诱饵的Y2Hgold酵母感受态——根据自激活结果涂布筛选平板——阳性结果点钟——阳性菌培养提质粒——PCR阳性鉴定——送测——测序结果分析 单杂筛选:诱饵重组质粒PABAI载体构建——线性化诱饵重组质粒和PGADT7空载转化Y1Hgold酵母宿主进行自激活验证——文库质粒转化含诱饵的Y1Hgold酵母感受态——根据自激活结果涂布筛选平板——阳性结果点钟——阳性菌培养提质粒——PCR阳性鉴定——送测——测序结果分析
可以通过启动子序列分析查找,确定探针设计范围,如果范围太宽泛,可以先将0.5-1kb片段克隆到荧光素酶报告载体验证其启动子活性以及是否受到该转录因子调控;寻找核心启动子可以通过分段截断验证。如果研究的转录因子具有已知的结合序列motif,则可以在该motif位点选择探针。也可以先进行ChIP或DNA pull down找到富集序列之后,再设计分段探针进行验证。
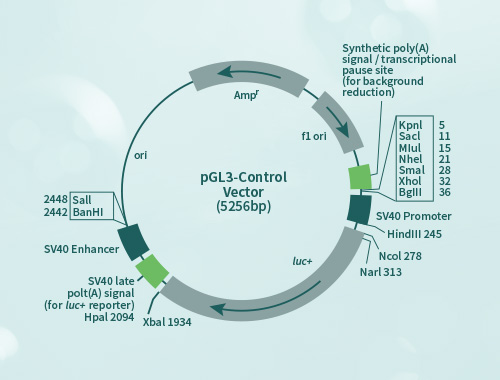
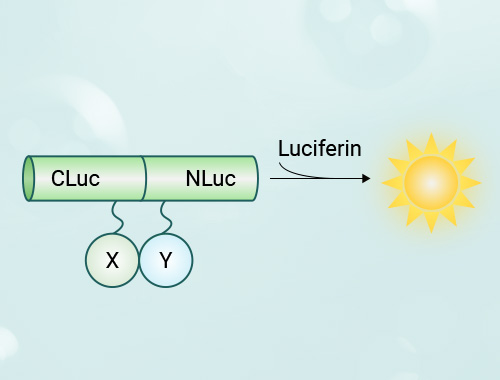
a.启动子结构分析,将启动子区域序列(通常2k左右)进行分段截短,或对特定位点进行突变,再分别构建入luciferase报告载体,检测其启动子活性。b.启动子SNP分析,一些基因的启动子区域存在单核苷酸多态性,可运用荧光素酶报告系统分析其相对活性。c.验证特定转录因子同其调控序列的作用,将该序列(通常为启动子区域)插入报告基因载体,同时在实验细胞中共转过表达该转录因子,可分析转录因子过表达是否提高荧光素酶活性。d.可以分析信号通路是否激活,将该信号通路的下游响应原件序列构建入报告基因载体,在不同上游信号条件下,荧光素酶活性代表了通路的下游响应。例如在GPCR研究中,将cAMP response element(CRE)载入报告基因载体,构建稳定表达细胞株后,可以用于分析GPRC的激活与抑制剂筛选。又如,将HIF1α的响应原件hypoxia-responsive element (HRE)插入luciferase报告载体构建稳转细胞株,可以用于低氧相关通路的研究。e.验证microRNA的靶序列,将待测的3’UTR序列插入报告基因载体,再共转入该microRNA,如果荧光素酶活性下降,则提示为其靶序列。
Luciferase的灵敏度相比于GFP提高10-100倍以上,同时具有更宽的动态范围,便于数值分析比较,不需要荧光显微镜,而且在活体实验中其荧光穿透性高于EGFP等荧光蛋白,同时由于没有内源活性、其本底信号很低。 而GFP等荧光蛋白相比于荧光素酶的优势在于可以进行失踪定位,并且其观测不需裂解细胞,方便进行适时观察。
海肾荧光素酶和萤火虫荧光素酶相比,相对活性如何? 在氧、镁和ATP的存在下,萤火虫荧光素酶作用于萤火虫荧光素,而来源于海洋腔肠(Renilla reniformis)的荧光素酶在氧的存在下作用于海肾荧光素。双报告基因技术(Dual-reporter assays),结合了萤火虫荧光素酶测试和海肾荧光素酶测试。
转染效率低的话可以从三个方面改善,首先要确保细胞状态是好的,通常我们选出处于分裂期的细胞,另外阳性对照您可以选择过表达的荧光蛋白质粒,还有就是DNA的质量尤为重要,最好是先酶切验证。 这个实验检测结果很灵敏,有一定差异是正常的,通常只要确保它在一个数量级之内即可。如果差异超出这个范围可以从两方面改善,一是记住保持样本的均一性,二是加样要准确。
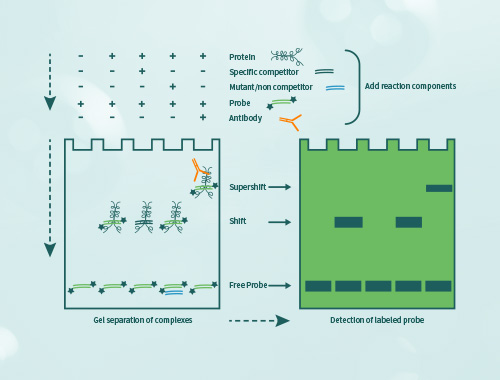
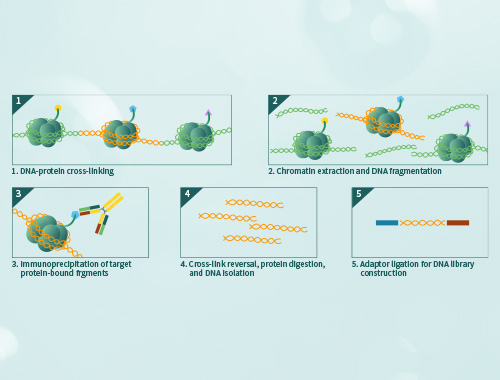
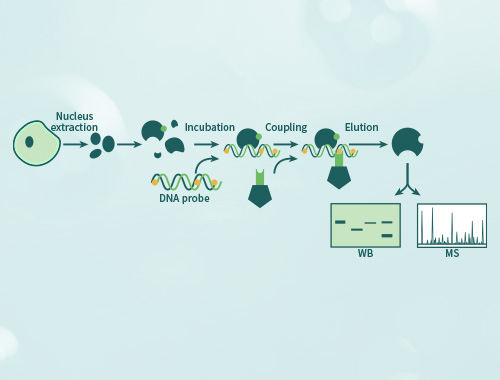
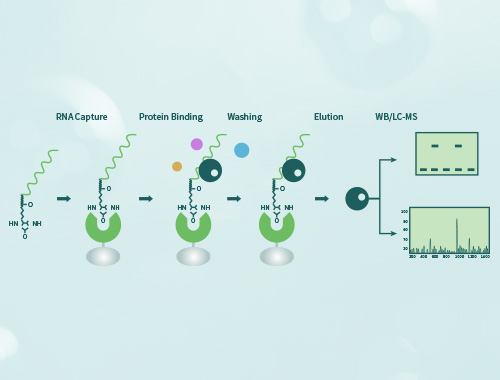
凝胶迁移或电泳迁移率检测(Electrophoretic Mobility Shift Assay,EMSA)是一种检测蛋白质和DNA序列相互结合的技术,可用于定性和定量分析;目前已用于研究RNA结合蛋白和特定的RNA序列的相互作用,是转录因子研究的经典方法。 金开瑞提供EMSA检测技术服务,帮助您检测DNA结合蛋白、RNA结合蛋白、特定的蛋白质,并可进行未知蛋白的鉴定。
当客户用组织或细胞核蛋白进行实验时,无法确定与探针结合的具体蛋白,需要再提供要研究的抗体,再进行supershift实验。如果抗体能识别与探针结合的蛋白,则会出现一条超迁移条带,即可证明探针与蛋白的结合。需客户提供IP级别的抗体。
使用天然组织细胞样本进行实验,通过抽提核蛋白获取目的蛋白,此为混合蛋白,如要确定某个蛋白结合于探针时,需要加入抗体观察是否形成超迁移条带。可以通过重组蛋白表达系统(如金开瑞的大肠、酵母、哺乳、无细胞等)获得特定的重组蛋白,后续实验中如出现迁移条带,则应源于该蛋白的结合作用。
除了探针序列具有理论预测性、本身属于探索性实验的情况之外,组织细胞中该转录因子丰度较低、只在特定条件阶段表达,特定蛋白同DNA结合需要一定的离子或辅助因子条件(如Mg2+、Zn2+、ATP),重组表达蛋白在DNA结合活性方面同天然蛋白存在差异,结合力较弱,需要其他蛋白间接作用于DNA等情况下,都难以获得迁移条带。此外,当研究的蛋白本身pI较大(如大于8.0),蛋白在native电泳中将难以随同DNA一起向阳极泳动,或在电泳最初阶段同DNA解离开。
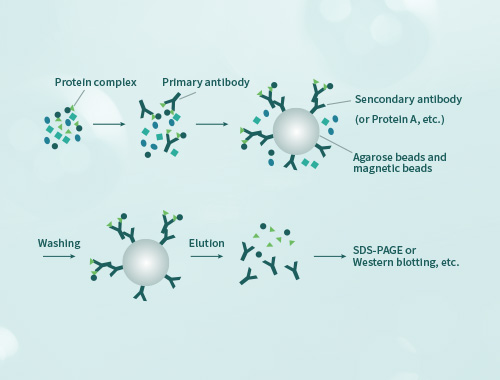
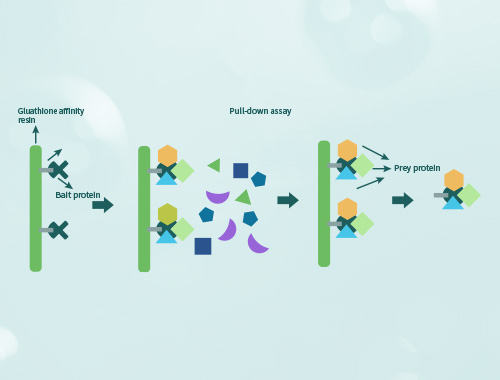
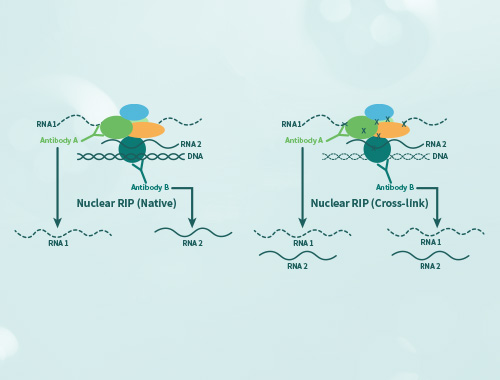
免疫沉淀(Immunoprecipitation,IP)是利用抗原抗体特异性反应纯化富集样品中目的蛋白的一种方法。通常使目标蛋白同抗体-protein A/G形成免疫复合物沉淀而得以收集,然后通过WB检测目的蛋白。 免疫共沉淀(Co-Immunoprecipitation,CO-IP)是将样品中同抗体靶蛋白相互作用的蛋白一同随免疫复合物沉淀,可以检测两种目标蛋白质是否在体内存在相互作用,也可以确定一种蛋白在体内的相互作用蛋白。
coIP实验需要保证足够的蛋白浓度才能维持原本存在的蛋白互作状态,尤其当蛋白丰度较低、相互作用力不强、使用不易提蛋白组织等情况时。而且coIP的实验条件往往需要反复摸索。因此用于coIP实验需准备细胞>2x107,动物组织>500mg,植物组织>2g,并且须更加注意采集后速冻-80℃保存和避免反复冻融。
a.所使用的抗体不仅需要优秀的亲和力、特异性,其识别表位还可能被互作蛋白所掩蔽(主要是使用单抗时); b.当蛋白互作须发生在特定生理代谢条件、组织细胞类型之中时,coIP实验可能无法获得互作结果; c.如果诱饵蛋白和或捕获蛋白在样本中丰度很低时; d.两个互作蛋白的亲和力较弱; e.当该蛋白互作需要较特定的离子强度,或者需要如Ca离子/Mg离子/ATP等辅因子时,要创造合适的反应条件会变得困难; f.一些样品处理提取存在难度,提取足量目的蛋白与保持蛋白天然状态,需通过实验条件达到优化平衡; g.外源表达的标签蛋白存在同内源蛋白的位点竞争,这主要在使用标签抗体进行实验时可能存在。
在coIP-WB鉴定结果中,IgG组无目的蛋白条带、IP组有目的蛋白条带,说明IP过程成功;银染胶图中,IP组相对于IgG组有更多蛋白条带、且存在差异,说明coIP过程捕获到互作蛋白;IP产物在质谱检测中鉴定到的蛋白数量不能作为判断实验成败的标准,因为这取决于目的蛋白本身所具有的互作蛋白数量、结合力强弱等方面;IP产物的质谱鉴定数量越多并不代表结果越好。
coIP所获取的样品,可以借助特异性抗体进行WB验证某种特定蛋白的存在(即认为互作蛋白),也可进行蛋白质谱鉴定找出互作蛋白,尤其当寻找未知互作蛋白时更需通过质谱分析。 直接用细胞组织内源蛋白进行实验发现的互作蛋白可能是通过其他蛋白形成复合物,当pull-down体系中仅有两个重组蛋白、仍然能存在互作时,说明这两个蛋白是直接互作而不是通过其他蛋白形成多聚复合物。 将蛋白进行分段阶段表达之后进行pull-down,可以分析发生互作的结构域;将蛋白进行突变后表达,可以分析互作发生的关键氨基酸位点。