实验原理
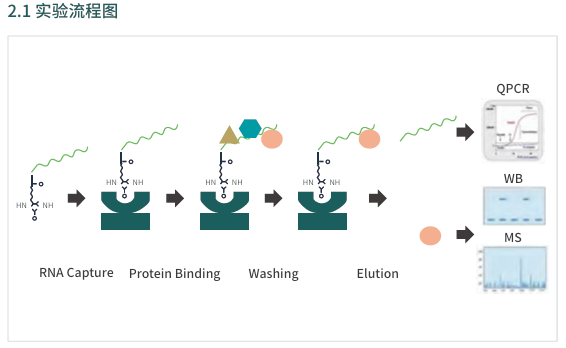
RNA pull-down是研究细胞内RNA与蛋白/RNA结合情况的技术。先将RNA进行标记(如生物素标记),再与细胞裂解液共同孵育,从而形成RNA-RNA/蛋白质复合物,进而检测与之结合的RNA或蛋白质。复合物洗脱后,通过荧光定量PCR(RNA pull down-QPCR)或高通量测序(RNA pull down-seq)方法来鉴定目标RNA是否与某些RNA分子相互作用,通过Western blot(pull down-WB)实验和质谱(pull down-MS)技术检测目标RNA是否与某些蛋白相互作用。
产品优势
• 特异性:磁珠背景噪音低;无关 RNA 或突变 RNA 不会显著影响特定 RBP 的富集。
• 超高灵敏度:可检测低丰度RNA及弱相互作用蛋白,适用于珍贵样本(如临床活检、单细胞样本)。
应用范围
RNA-蛋白质互作研究:
• 发现新型RNA结合蛋白:捕获特定RNA(mRNA、lncRNA、circRNA等)的相互作用蛋白,揭示未知调控网络。
• 验证已知互作:精准检测目标RNA与候选蛋白(如转录因子、酶)的物理结合,支撑机制研究
• 非编码RNA功能解析和生物标志物挖掘
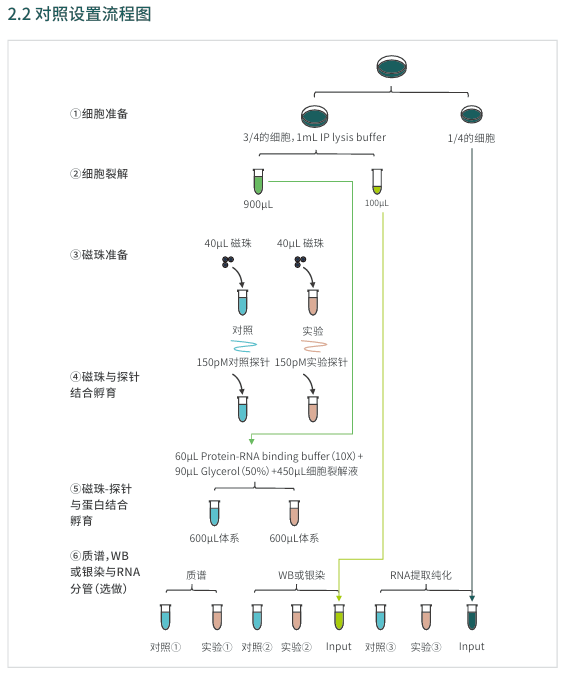
实验流程
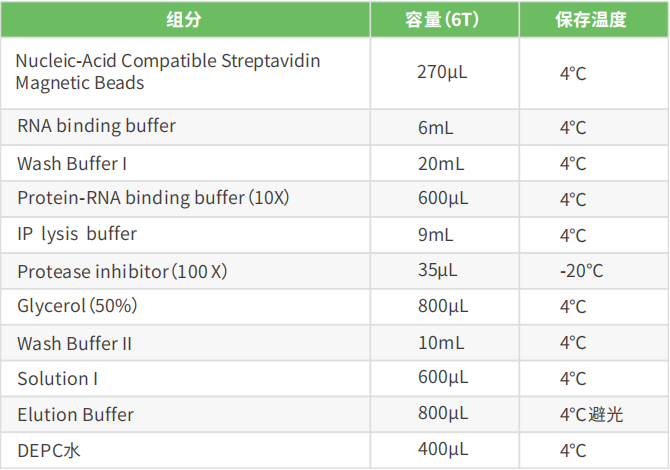
试剂盒组分
常见问题与解答
Q1: 实验全程如何预防RNA降解?
实验使用的所有试剂耗材需经过去RNA酶处理。
Q2:RNA pull-down⼀定要体外转录合成RNA探针吗?
体外转录只是获得RNA的⼀种⽅式,相比化学合成纯度更高。所以pull-down实验⼀般是体外转录得到目的RNA。当目的RNA序列大于2000bp时体外转录就不太容易转录成功,这时我们可以设计合成⼀小段目的RNA探针,通过探针与目的RNA结合,再与蛋白结合,便可绕过这个问题。
Q3:RNA在转录出来后,其OD⼀般都不高,可以使用吗?如何定量呢?
OD值不高可进行RNA纯化,即便不纯化在实验中多加⼀些RNA亦可。而定量问题⼀般会进行琼脂糖凝胶电泳检测,可以根据marker浓度来判断RNA的浓度。也可以用仪器测量RNA的浓度,但通过体外转录得到的RNA浓度都能达到2μg/uL以上。并且pull-down实验不需要精确的定量,都会加入过量的探针。
Q4:关于样本处理,细胞或者组织裂解时要不要加蛋白酶抑制剂或RNA酶抑制剂?还需要进行其他处理吗?操作过程中需要注意什么?
细胞裂解需要加⼊蛋白酶和RNA酶抑制剂,最好能够进行超声处理。另外裂解蛋白的全程尽量在冰上操作。
Q5:lncRNA引物设计有什么注意事项?或者说与普通的引物设计有什么区别?
体外转录扩增的引物只需要在正向引物5’端加⼊T7启动子序列即可。
Q6:质谱鉴定的蛋白主要是依据打分来进行筛选?这个筛选多少分算有效?
pull-down富集蛋白质谱分析后会剔除不可信蛋白,交付的都是可信蛋白,没有明确的打分。需要排序的话⼀般是根据鉴定蛋白特征性肽段的数目作为参考。
Q7:做lncRNApull down+质谱⼀般都会发现多个互作蛋白对吗?如何选择哪一种蛋白继续研究下去?
不同的RNA结合蛋白数量不等,根据实际鉴定的蛋白进行筛选;筛选的原则是根据自己研究的方向或相关功能确定这类蛋白。