实验原理
酵母核/膜体系文库构建试剂盒,提供了一种从总RNA或者poly A+RNA获得高质量全长cDNA文库的方法。本试剂盒在GAL4酵母单双杂系统以及基于分离的泛素(split-ubiquitin)介导的膜蛋白酵母双杂交系统上,通过对PGADT7以及pPR3-N载体进行改造,额外增加了三框文库的构建。本产品适用于从100~500μg不同来源的真核生物总RNA中,经过mRNA分离、单链cDNA合成、双链cDNA合成、双链cDNA分选、小量连接转化、大量连接转化,构建获得高质量的酵母cDNA文库。只需要一份样品,合成一份双链,即可同时构建获得核体系、膜体系文库。
产品优势
金开瑞根据诱饵蛋白的定位自主研发了核蛋白酵母双杂交建库试剂盒、核/膜蛋白酵母双杂交建库试剂盒及膜蛋白酵母双杂交建库试剂盒。相较于市面上其他的同款产品,本试剂盒针对建库质量做了以下优化:
1、升级反转录酶:显著增加了热稳定性和半衰期,提高cDNA合成效率和片段完整性。
2、改造PGADT7和pPR3-N载体:创新的三框文库构建方法,可保证片段长度、阳性率和文库滴度等信息的一致性。
3、引入CCDB自杀基因:极大降低了空载的产生,基本实现100%阳性率。
4、DH10B:经过了高抗性压力筛选,提高文库转化率。
5、超高性价比:提供全套必需试剂,无需额外购买,简化实验准备工作。
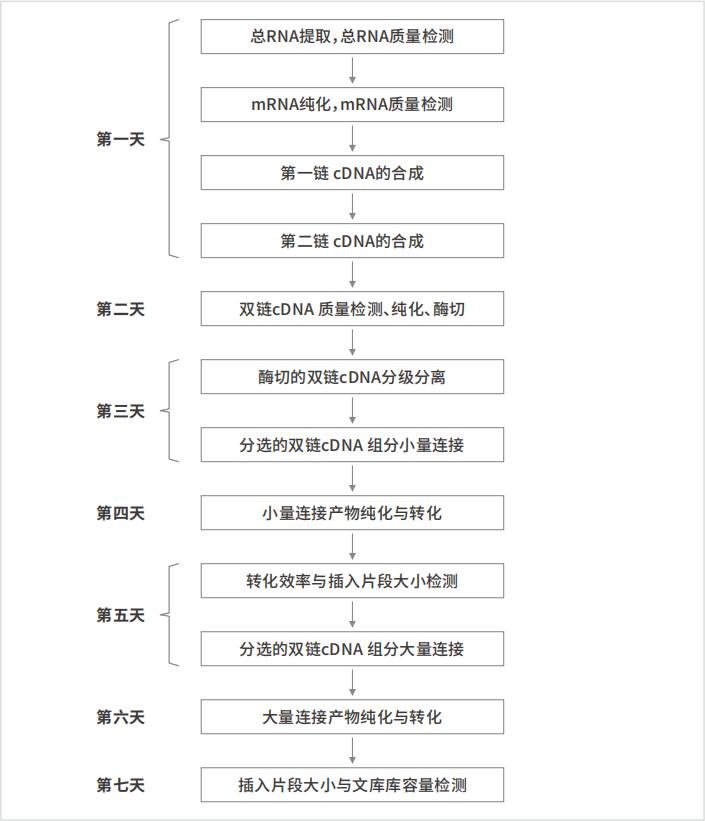
实验流程

实验时间表
结果展示
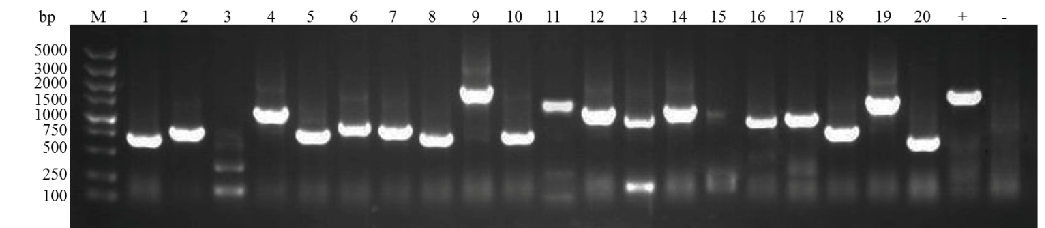
酵母核体系文库构建:文库插入片段PCR鉴定70%在750bp以上,文库的阳性率>90%
+:以PGADT7-T为模板
-:以水为模板

酵⺟膜体系⽂库构建:文库插入片段PCR鉴定80%在750bp以上,文库的阳性率>90%
+:以pPR3-N为模板
-:以水为模板
常见问题与解答
Q1:对于核体系酵母文库和膜体系酵母文库,该如何选择试剂盒?
对于亚细胞定位显示定位在细胞核的蛋白,选择膜蛋白酵母双杂交建库试剂盒;对于定位在细胞膜的蛋白,则选择核/膜蛋白酵母双杂交建库试剂盒;对于定位在细胞质的蛋白,可以选择核/膜蛋白酵母双杂交建库试剂盒。
Q2:核体系酵母文库和膜体系酵母文库在构建上有什么区别?
核体系酵母文库是基于GAL4酵母单双杂的系统,通过对PGADT7序列载体进行改造,而膜体系文库是在基于分离的泛素(split-ubiquitin)介导的膜蛋白酵母双杂交系统上,通过对pPR3-N序列载体进行改造。两款试剂盒使用的载体不同,但实验方法几乎都是一致的。
Q3:双链cDNA跑胶条带小于预期大小
使用的总RNA或者mRNA存在降解、样品不纯、浓度太低等问题,可以通过以下方法解决:
(1)通过琼脂糖凝胶检测总RNA和mRNA的质量,确保质里和纯度均没有问题(如果RNA质量很好,但浓度太低,则使用更多的RNA来进行双链的合成;如果RNA质量不行,则需要重新提取RNA);
(2)对RNA的稳定性进行检测,如果RNA容易降解,检查所用的离心管、tip头等是否有RNase的污染,并换一种方法重新提取总RNA;
(3)为了更容易地确定是否是RNA的问题,请使用对照RNA进行平行反应。
Q4:如何检测文库质量,文库容量低应该怎么解决?
对于我们提供的大肠杆菌文库甘油菌,可以进行梯度稀释后铺板培养,第二天计算库容量,同时挑取单克隆进行PCR扩增,以判断插入片段长度和空载率。如果检测出文库容里低,有可能是连接效率低,可以通过以下两种方式解决问题:
(1)检查分级分离后双链cDNA的浓度,双链cDNA的浓度应该在100~200 ng/uL的浓度范围内;
(2)按照试剂盒说明书中的连接体系,连接体系中线性化载体和双链产物的配比不合适,或者连接体系中这两者所加入的里太多均会影响连接效率。
Q5:双链cDNA产物中存在较多<0.1Kb的条带?
可能是PCR的循环数太多了,重新使用第一链产物进行第二链的合成PCR时减少3~4个循环数。
相关产品&技术服务
相关产品
⇒ 银染试剂盒(Silver Stain Kit) ⇒ Co-IP试剂盒(植物)
⇒ DNA pull-down试剂盒(动物) ⇒ DNA pull-down试剂盒(植物)
相关技术服务
► 双荧光素酶报告系统 ► 酵母双杂交 ► EMSA ► RNA pull-down
► RIP-qPCR ► DNA pull-down ► ChIP-qPCR ► 酵母单杂交