分子互作 | 蛋白-DNA互作专题之EMSA
分子互作是生命体的普遍主题,分子互作技术作为生命科学的基础技术现已广泛应用于生命科学研究的方方面面。本文是分子互作专栏的第三篇文章,主题是“蛋白-DNA互作专题之EMSA”。
EMSA原理
凝胶迁移或电泳迁移率实验 (electrophoretic mobility shift assay,EMSA)是一种研究DNA 结合蛋白和其相关的 DNA 结合序列相互作用的技术,可用于定性和定量分析( HellmanLM and Fried MG, 2007) 。
这一技术最初用于研究 DNA 结合蛋白,目前也可用于研究 RNA结合蛋白和特定的 RNA 序列的相互作用 (Rio, 2018)。在实验中,通常将纯化的蛋白或细胞粗提液和生物素标记的 DNA 或 RNA 探针一同保温,在非变性的聚丙烯凝胶电泳上,分离复合物和非结合的探针。
其中 DNA-复合物或 RNA-复合物比非结合的探针移动得慢,而探针移动的较快。EMSA实验根据实验方案设计的不同,分为验证型 EMSA、竞争型 EMSA和超迁移 EMSA。
验证型EMSA
用于验证探针是否含有可与蛋白质结合的位点。探针与纯化蛋白混合孵育,探针与蛋白结合与否,可以直接表明探针和蛋白的互做关系。蛋白提取液中蛋白质混杂,种类不单一,探针可能与多种蛋白结合。
因此,探针与蛋白提取液混合孵育,可以验证探针上是否含有蛋白结合位点,但是无法得知是何种蛋白与探针结合。
竞争型EMSA
与探针序列相同,不含修饰基团的 DNA 片段称为冷探针。
在探针与蛋白质混合液中加入大量冷探针,冷探针含有和探针相同的 DNA 序列,会干扰探针与蛋白的结合。在电泳图的相应位置处,电泳带的的信号减弱或消失。
探针和蛋白的结合未必是特异性结合,或者蛋白本身可能含有生物素,二者均能产生假阳性的实验结果。增加一个冷探针的干扰实验,可以排除假阳性结果,增加实验结果的准确性。
超迁移EMSA
超迁移 EMSA 利用到了与待检测的目的蛋白特异性结合的抗体。
如果蛋白质溶液不是单一的纯化蛋白,无论是验证型 EMSA,还是竞争型 EMSA,都无法证明和探针结合的蛋白质就是我们所预期的。在实验体系中引入特异性抗体,用抗体特异性地结合蛋白-探针复合物,这就是超迁移 EMSA。
蛋白-探针复合物被抗体识别并结合,该三聚复合物在凝胶电泳中,迁移速率再次增大,电泳带出现在蛋白-探针复合物的上方。超迁移 EMSA 是以竞争型 EMSA 为基础的实验方案。
超迁移 EMSA 的实验结果可以很好地验证探针是否和蛋白结合,是否是特异性结合,与探针结合的蛋白是否是预期的蛋白质。
EMSA技术路线

实验流程:
1、细胞总蛋白/核蛋白提取,或者蛋白外源表达;(总量≥100μg,纯度>80%、浓度>0.5ug/μl)
2、DNA探针合成及生物素标记;
3、泳道设定及浓度梯度设定(需客户提供上样顺序);
4、DNA-蛋白凝胶电泳;
5、转膜;
6、紫外灯交联;
7、化学发光显色反应;
EMSA送样要求:
①细胞沉淀:不少于20μl,细胞>107,干冰寄送;
②动物组织:不少于0.2g,新鲜取材,干冰寄送;
③植物组织:不少于0.5g,新鲜幼嫩组织,干冰寄送;
④重组蛋白不少于50μg(NTA或TE溶);
shift-EMSA需提供IP级别抗体,不少于10μl。
注意事项:
蛋白尽量在上清中表达,包涵体中蛋白在复性过程中可能不能完全复性,导致蛋白空间结构不能完全恢复,这样可能影响EMSA实验中与DNA的结合,需提前给客户说明。
解决方法:
①前期蛋白表达难易度评估时,对预计可溶性不佳的蛋白(或沉淀可能性大的蛋白),或蛋白预计不可溶,建议连亲水标签pet-sumo;
②可以先考虑包涵体复性,其次可考虑跟客户沟通换载体、换表达系统等;
③优化实验条件,如低温16℃、高温37℃诱导蛋白表达,尽量降低蛋白折叠的可能性。
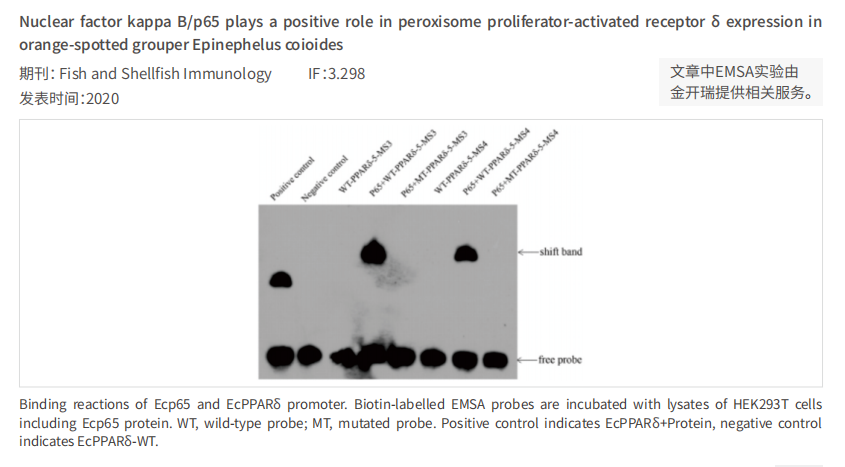
案例分享:
最新动态
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!
-
03.20
双荧光酶数据分析指南!!!
-
03.20
【合作文献分享】双剑合璧!外泌体研究新成果揭示癌症治疗新方向










