你还在做ChIP吗?推荐使用CUT&Tag新技术
CUT&Tag(CleavageUnderTargetsandTagmentation),即靶向剪切及转座酶技术,是⼀种利⽤酶锚定技术进⾏⾼效、⾼分辨率的DNA测序⽂库构建⽅法,也是替换传统的ChIP-Seq⽤以研究蛋⽩质-基因组互作关系研究的新⽅法,属于新⼀代超微量ChIPSeq技术。可⽤于检测组蛋⽩、RNApolymeraseII和转录因⼦等具有DNA结合功能的蛋⽩种类,对表观遗传学、肿瘤和⼲细胞等领域的研究具有重要意义。
结合了ChIP-seq的优点和基于Tn5转座酶的tagmentation⽅法,能够快速、⾼效地鉴定染⾊质上蛋⽩质的结合位点。相较于传统的ChIP-seq技术,Cut&Tag具有更快的实验速度、更⾼的分辨率和更低的细胞输⼊要求。
原理简介
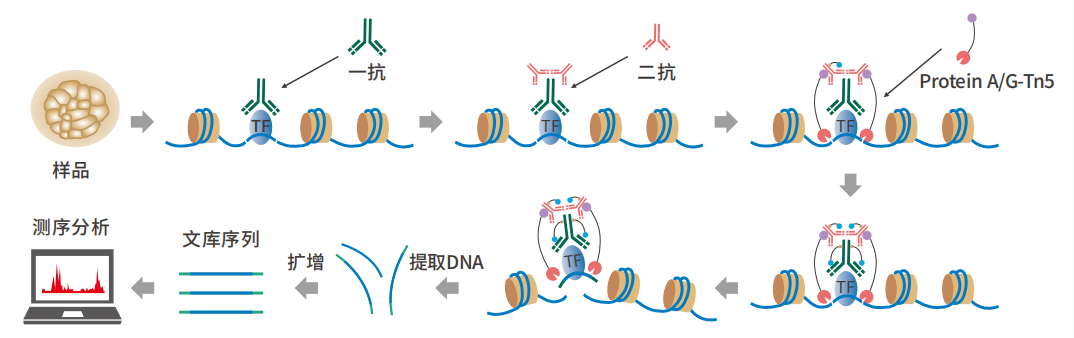
在抗体引导下,ChiTag酶仅在⽬的组蛋⽩修饰标志、转录因⼦、染⾊质调控蛋⽩结合染⾊质的局部进⾏⽬的 DNA的⽚段化的同时添加测序接头,并释放到细胞外,⽽绝⼤部分⽆关的染⾊质还留在细胞核内,因⽽整个实验的信噪⽐⼤幅提⾼,同时简化了实验步骤。该⽅法可⼀管式⾼通量应⽤,并可与单细胞测序平台「⽆缝」结合。ChiTag酶在打断基因组的同时加上接头,不需要繁琐的补平加 A加接头,在⼀天内可以完成从细胞到测序⽂库制备全流程。

实验流程
CUT&Tag技术优势
01
无需甲醛交联、去交联、DNA打断、标记,因此实验周期更短
CUT&Tag实验流程中,pA-Tn5酶的使用是一个重要创新[1],这种融合蛋白可以实现与二抗的互作,并能够实现对目标区域的直接切割和标记,从而不再需要对细胞进行甲醛交联和DNA片段化,可将整个实验周期缩短至一天。

02
信噪比更高,细胞需求量大大降低
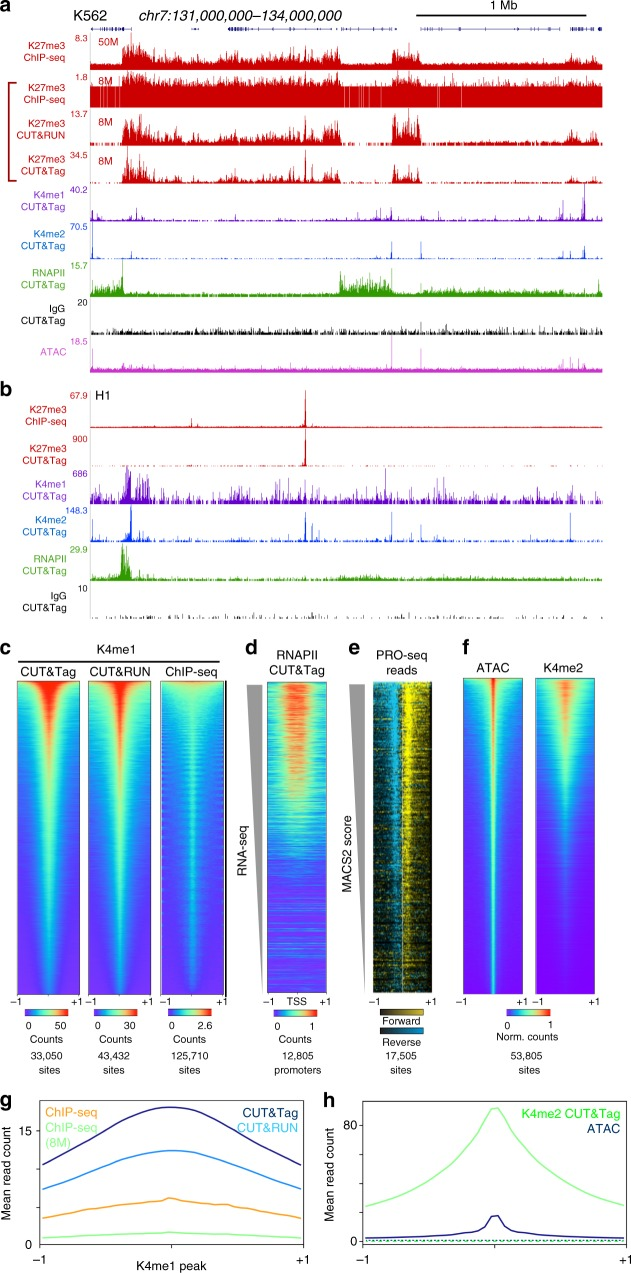
CUT&Tag在peak区域展示出远高于ChIP-Seq和CUT&RUN的信号强度,且背景远低于ChIP-Seq。同样由于pA-Tn5酶的使用,CUT&Tag技术可同时完成对目标区域DNA的片段化和测序接头添加,并将片段化产物释放到细胞外。在此过程中,绝大部分非特异性染色质区域还留在细胞核内,因此整个实验的信噪比大幅提高。
03
重复性好,信号富集强
由于整个实验步骤的减少,相比于ChIP-seq和CUT&RUN,CUT&Tag在重复样本之间表现出更高的数据相似度,可重复性高。相关性热图表明,对于H3K4me1这个标记,CUT&Tag的两个重复样品表现出更高的信号组内相关性;在测序数据量相同的情况下,CUT&Tag的peak region内数据量更多,信号更强。

04
能对极少量细胞甚至单细胞进行分析
得益于pA-Tn5酶的高敏感性,CUT&Tag技术可在单细胞水平实现DPI的分析。

05
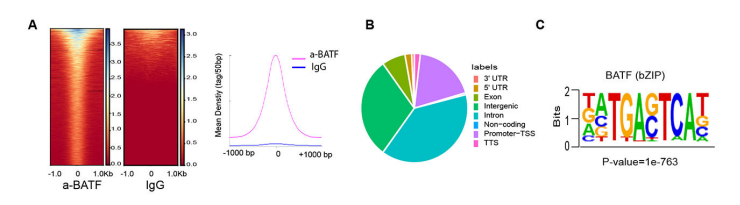
Peak在基因功能元件上的分布
为了进一步研究蛋白修饰的结合位点特征,理解蛋白修饰对基因调控的机制,统计peak在各基因功能元件分布个数,使用R包绘制peak在基因功能元件上分布饼图和upset图,比如基因功能元件分布在Promoter、5’UTR、3’UTR。
06
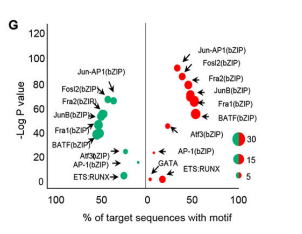
Motif分析
Motif 是具有某种生物特性,在一组相关序列中重复出现的序列模式,是研究基因表达调控机制的重要信息。CUT&Tag所研究的转录因子或组蛋白,其结合位点可能存在特定的序列特征。为尝试得到这种修饰结合的保守序列信息(motif 序列),进一步理解蛋白修饰对基因表达的调控,选取call peak得到的summit上下游250bp的序列进行motif预测。
CUT&Tag是研究蛋白质与DNA相互作用的一种较新的分子生物学方法,与ChIP-Seq和CUT&RUN相比具有一些优势,当然也会有一些局限性。
CUT&Tag技术的局限性
尽管CUT&Tag很有前景,但它确实存在一些局限性,可能会阻止它完全取代ChIP-Seq分析。
01
CUT&Tag的非交联方案并不总是合适的
非交联细胞不适合每项实验。在最初的CUT&Tag文献中,只测试了组蛋白修饰、NPAT和CTCF。许多转录因子表达不丰富,弱或短暂地与DNA结合,或间接地与染色质结合。在这些情况下,染色质交联和超声是检测蛋白质-DNA相互作用的必要步骤。
此外,大多数经ChIP验证的抗体可在交联条件下工作,并且可能无法在非交联条件下工作,因为交联条件下的蛋白质表位的可识别性可能不同于天然条件。因此,从ChIP转换到CUT&Tag需要彻底的抗体验证,以确定抗体在不固定条件下的特异性和敏感性。
02
CUT&Tag仍然是新技术
虽然CUT&Tag似乎已经流传了很久,而且很快就流行起来了,但它只是在2019年4月才首次发表。目前采用此项技术研究发表的文章也较少。
03
CUT&Tag可能会引入偏差
用于CUT&Tag的Tn5转座酶对染色质开放区有很高的亲和力。因此,CUT&Tag方法可能更适合于分析组蛋白修饰或与基因组活跃转录区域相关的转录因子,而不太适合分析沉默或含有异染色质的基因组区域。消化时间和pA-Tn5的使用量需要针对每个目标物进行仔细优化,以避免任何不特异的标记。
CUT&Tag是一种很有前途的技术,如果这种方法像ChIP-Seq那样被广泛采用,时间会告诉我们答案。像每一个新的方法一样,所有的缺陷都还没有被检测出来,所以CUT&Tag的优化必须小心地进行,并且工作流程中的每一步都应该进行适当的质控。
技术应用
CUT&Tag技术对实验室常规的模式生物和细胞系都有很好的适用性。这些模式生物包括人、动物、植物、微生物样本。CUT&Tag技术在HepG2 cell、RAW246.7 cell、KYSE cell、Human primary cell、Human Tissure cell、hPSCs、K562 cell、mouse ES cell、HEK293T cell、mouse MEFs cell、mouse embryos cell、mouse brain cell、NIH3T3 cell、CD4+T cell、HeLa S3 cell、H1 hESCs cell、CD8+T cell、果蝇细胞、muscle stem cell、拟南芥、水稻、棉花等细胞样本中已经得到了应用,可见,CUT&Tag技术对实验室常规细胞样本具有广谱的适用性,含有细胞壁的细胞也适用。
金开瑞服务优势
1、细胞起始量较低(单细胞-5*10^5 ),从百万级降低到单细胞⽔平
2、结果可重复性较⾼,且信噪⽐较⾼
3、把繁琐的ChIP流程缩短⾄1-2天的时间
4、操作流程简单,⽆需甲醛交联、细胞破碎和超声⽚段化DNA
5、简化了⽂库构建流程,在转座⼦上添加了‘接头’,只需要简单的PCR即可获得⾼质量NGS⽂库
6、与ChIP相⽐,测序深度减少10倍左右
最新动态
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!
-
03.20
双荧光酶数据分析指南!!!
-
03.20
【合作文献分享】双剑合璧!外泌体研究新成果揭示癌症治疗新方向










