外泌体-热门研究方向分享
随着近几年外泌体发文量递增,众多科研工作者纷纷扎堆此领域,有关外泌体载药、诊断、免疫疗法等方向的文章陆续发表在各大顶级期刊上,外泌体无疑成为了基础研究和技术开发的热点,它在疾病诊断,疾病机理,药物开发等方面发挥着重要的作用。
外泌体概念
外泌体是一种能被机体内大多数细胞分泌的具有脂质双分子层膜结构的微小囊泡。动物类外泌体粒径大小:30 ~ 150 nm,植物类外泌体粒径大小:50~1000nm,大多数类型的细胞都可以分泌外泌体。外泌体广泛的存在于自然界中,无论是各种动物来源的细胞和组织,还是我们日常生活中吃的蔬菜和水果几乎都含有外泌体。外泌体是人体天然的“运输员”,携带多种蛋白质、mRNA、miRNA和脂质类物质等,它频繁穿梭于细胞之间,为细胞之间的通信提供了桥梁。
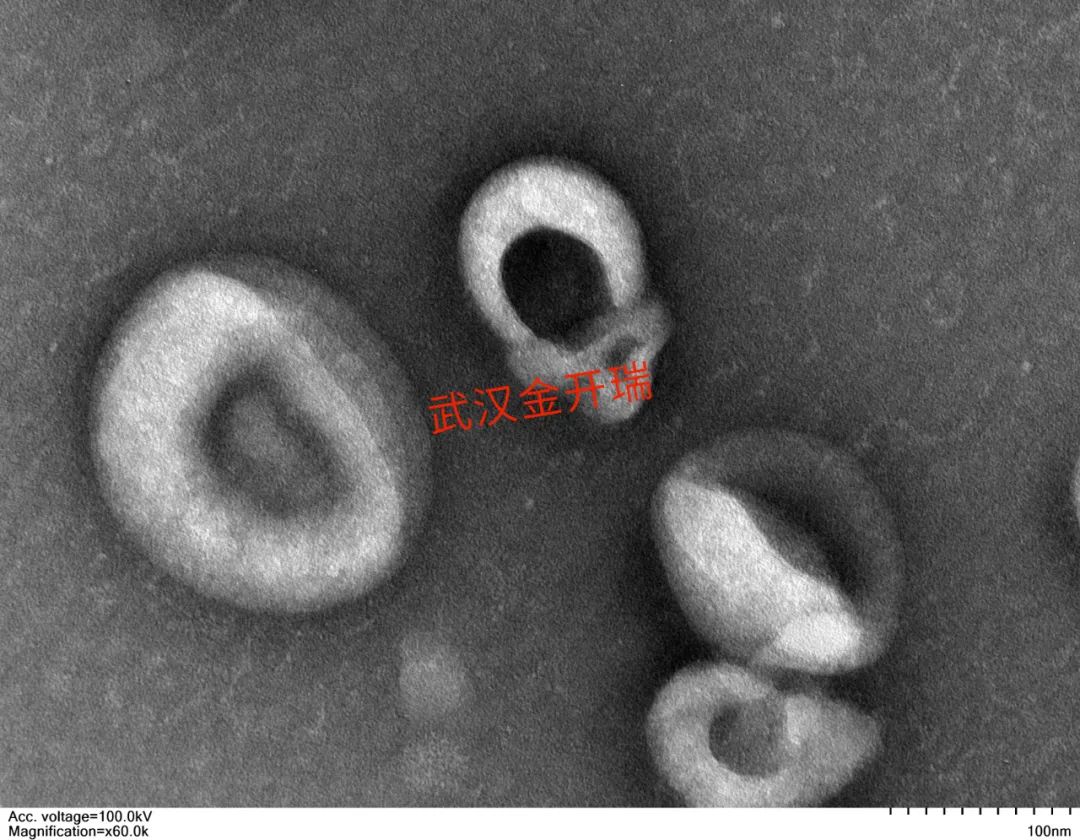
来源:Pegtel DM, Gould SJ. Exosomes. Annu Rev Biochem.[1]
外泌体应用
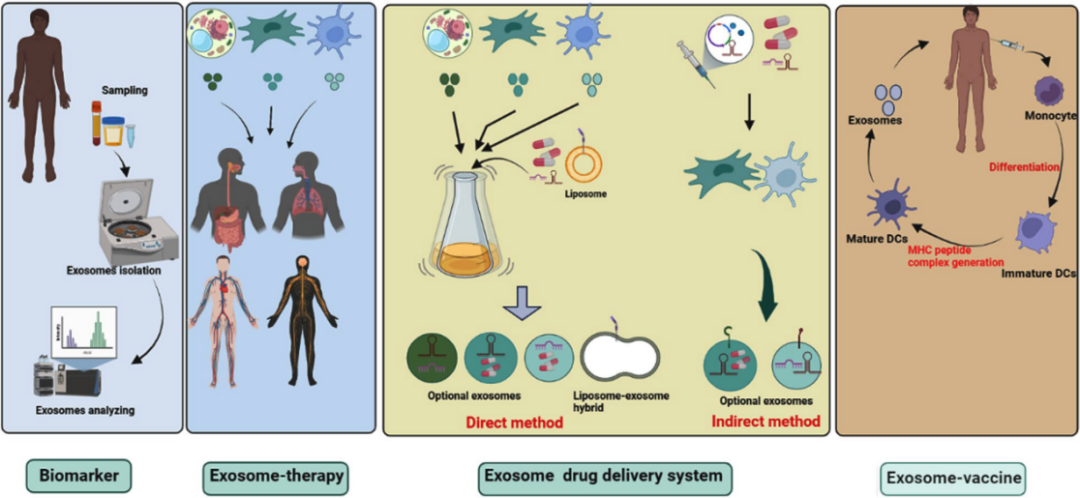
外泌体可以将活性生物分子传递到靶细胞,并在几种生理和病理过程中具有重要功能,显示出作为疾病新治疗策略的巨大前景。目前外泌体的主要临床应用是将其用作生物标志物、无细胞治疗剂、药物递送载体、外泌体动力学基础分析和癌症疫苗。来自人类或植物的不同外泌体被用于各种临床试验,大多数研究人员使用来自循环系统的外泌体进行生物标志物实验,越来越多的证据表明,外泌体在一系列细胞过程中发挥着关键作用,包括增殖、生长、发育、血管生成、免疫调节、感染、转移、重编程和重塑。
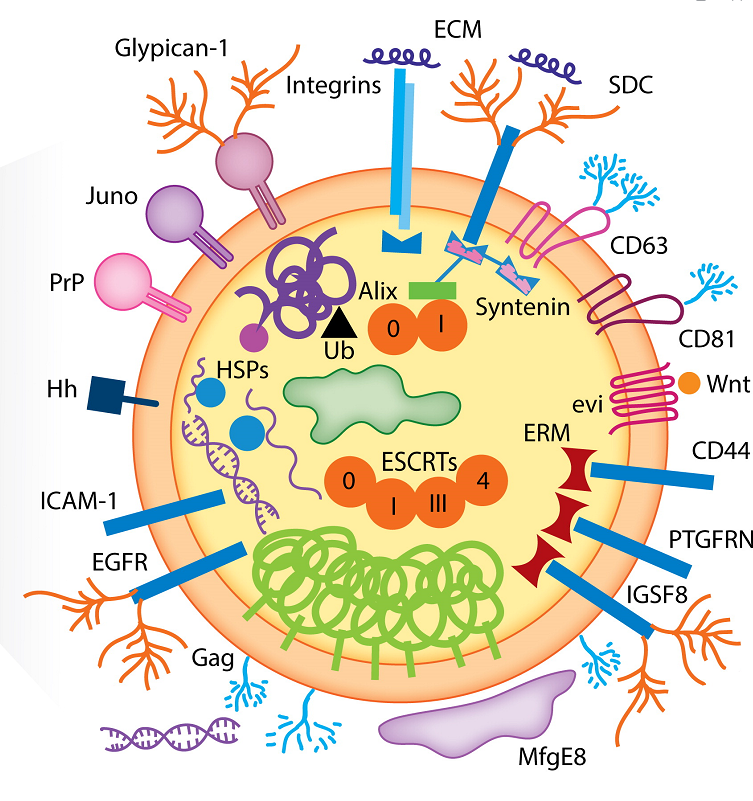
来源:A review on exosomes application in clinical trials: perspective, questions, and challenges[2]
1、外泌体作为诊断标志物
很多研究表明,大量外泌体富集于体液中并参与许多生理和病理过程,因此外泌体在液体活检中作为新型生物标志物具有很大的前景。液体活检的特点是通过血液、唾液和尿液等生物液体进行微创检测,已成为癌症诊断和预后预测的革命性策略。外泌体在大多数体液中是稳定的,可以保护生物分子免受降解。在病理条件下,细胞变化可以反映在细胞释放的外泌体的生物成分上。除此之外,外泌体的内容物可以通过转录组学、蛋白质组学和脂质组学研究进行鉴定和分析;因此,特定分子水平的差异将有助于生物标志物的应用。
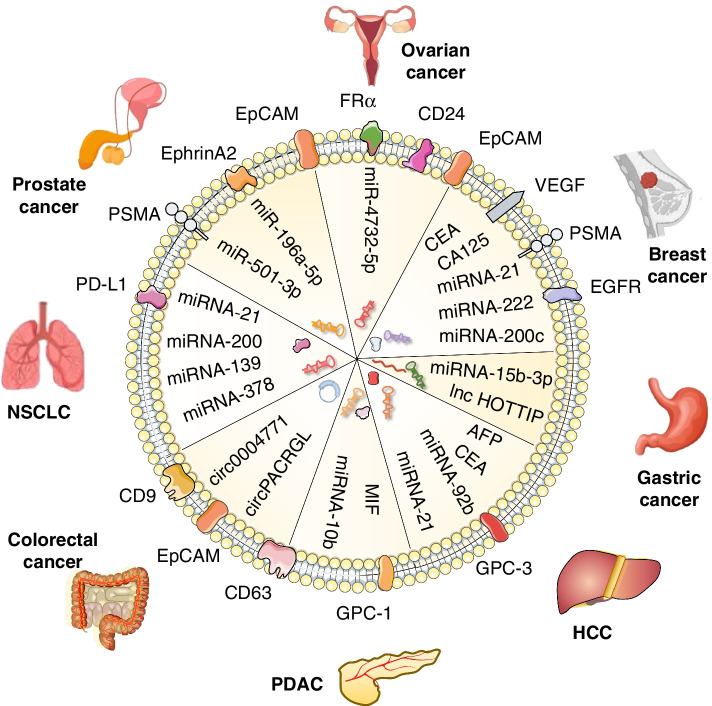
来源:Exosomes as a new frontier of cancer liquid biopsy[3]
2、外泌体用于药物递送系统
外泌体具有稳定性、低免疫原性和高生物相容性等独特特性,使其成为理想的药物递送载体,这些特征使外泌体能够有效地进入靶细胞,避免免疫系统的识别和消除,从而将外源蛋白质和核酸药物输送到靶细胞。外泌体还具有亲脂和亲水特性,通过增加药物溶解度和实现多种药物的共同递送来提高药物利用率,它们还能够进入血脑屏障,并有效地将药物输送到脑内区域,此外,还可以修饰外泌体的脂质双层结构以增强其靶向特异性。
随着动物类外泌体研究的兴起,很多人开始把目光转向了植物,植物类外泌体作为一种新兴的纳米材料,在生物进程中扮演着重要的角色。动物来源外泌体存在靶向性不足,进入体内易被快速清除而无法被靶细胞吸收,或与细胞膜发生相互作用。然而植物外泌体具有免疫原性低、高生物相容性、可改造性强等特点,通过工程化改造外泌体后,可以增强靶向性、避免被免疫系统清除,同时还可让其装载内容物,可以更好的应用于疾病的早期诊断和临床治疗。比如:人参衍生的外泌体纳米囊泡可作为一种安全高效的载体,将其所包含的活性miRNAs高效递送给骨髓间充质干细胞(BMSCs),进一步诱导其向神经细胞分化,在体内外均显示出加速神经再生与传导功能修复的效果。

来源:Plant Exosome-like Nanovesicles: Emerging Therapeutics and Drug Delivery Nanoplatforms[6]
3、外泌体用于抗肿瘤免疫治疗
外泌体可以很容易地穿过生物屏障,如血脑屏障,其进行修饰以提高效率。由于其转移能力、脂质双层结构和独特的表面蛋白,外泌体可用作药物、核酸和受体癌细胞蛋白质的纳米颗粒载体用于受体癌细胞,并且天然和改良的外泌体都提供了治疗性免疫学成分以达到控制和破坏肿瘤细胞的目的。
鉴于巨噬细胞在EVs介导的串扰中发挥的关键作用,调节巨噬细胞是肿瘤治疗的有效策略,因此,由M1巨噬细胞介导的抑制作用可以应用于癌症治疗。负载有氯素e6光敏剂(Ce6-R-Exo)的肿瘤衍生修饰外泌体可以通过光声成像可视化,并且可以在激光照射下有效地在肿瘤细胞中产生活性氧。它们还增加了细胞因子的释放,表明 R-Exos 可用作药物载体和免疫治疗剂。
外泌体还含有MHC I等肿瘤抗原,可用作癌症免疫治疗的疫苗,在APC存在下,DC衍生的外泌体可以加载几种肽抗原(例如,MHC I,MHC II),从而刺激CD4辅助性T细胞和CD8 CLT诱导抗肿瘤反应。
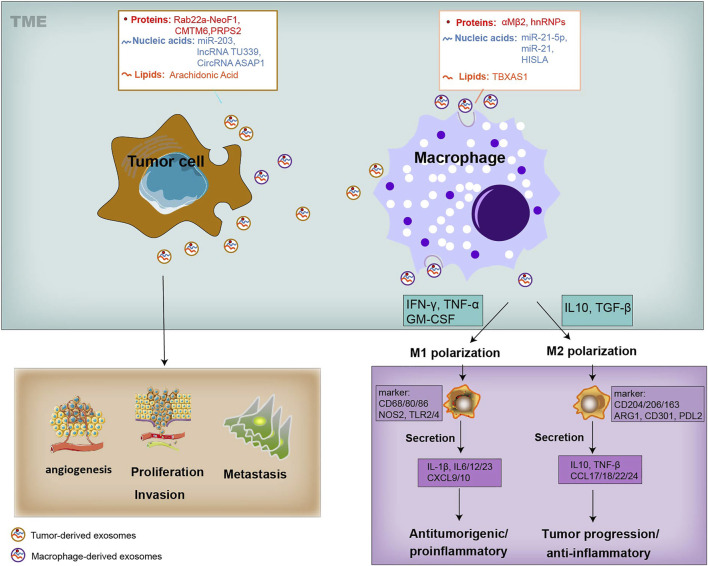
来源:Exosome-Mediated Crosstalk Between Tumor and Tumor-Associated Macrophages[7]
4、外泌体miRNA 研究
外泌体是一种脂质双层细胞外囊泡,含有不同的成分,包括蛋白质、脂质、DNA、信使RNA(mRNA)和非编码RNA。外泌体特殊的膜结构能够保护其内部的RNA免受酶的降解,相比于体液中的RNA来说,外泌体中各类RNA的含量更为稳定,浓度更高。在癌症中,位于肿瘤细胞衍生外泌体中的miRNA的表达失调,可能导致转移和治疗耐药,因此对肿瘤外泌体RNA进行相关研究,揭示外泌体RNA在肿瘤发生发展中的分子机制,将有助于肿瘤的诊断和治疗。
小结
目前,国内外相关的研究火热进行中,如何提高外泌体纯度,降低生产成本,实现产品工业化仍是目前面临的重大挑战。相信随着各领域行业大咖和高新企业的加入,将会有更多的外泌体产品问世,最终外泌体的产品将走向商业化,使更多患者受益。

参考文献:
[1]Pegtel DM, Gould SJ. Exosomes. Annu Rev Biochem. 2019 Jun 20;88:487-514.
[2] Rezaie J, Feghhi M, Etemadi T. A review on exosomes application in clinical trials: perspective, questions, and challenges. Cell Commun Signal. 2022 Sep 19;20(1):145.
[3] Yu D, Li Y, Wang M, Gu J, Xu W, Cai H, Fang X, Zhang X. Exosomes as a new frontier of cancer liquid biopsy. Mol Cancer. 2022 Feb 18;21(1):56.
[4] Xu XH, Yuan TJ, Dad HA, Shi MY, Huang YY, Jiang ZH, Peng LH. Plant Exosomes As Novel Nanoplatforms for MicroRNA Transfer Stimulate Neural Differentiation of Stem Cells In Vitro and In Vivo. Nano Lett. 2021 Oct 13;21(19):8151-8159.
[5] Zeng H, Guo S, Ren X, Wu Z, Liu S, Yao X. Current Strategies for Exosome Cargo Loading and Targeting Delivery. Cells. 2023 May 17;12(10):1416.
[6] Dad HA, Gu TW, Zhu AQ, Huang LQ, Peng LH. Plant Exosome-like Nanovesicles: Emerging Therapeutics and Drug Delivery Nanoplatforms. Mol Ther. 2021 Jan 6;29(1):13-31.
[7] Chen Q, Li Y, Gao W, Chen L, Xu W, Zhu X. Exosome-Mediated Crosstalk Between Tumor and Tumor-Associated Macrophages. Front Mol Biosci. 2021 Oct 13;8:764222.
最新动态
-
04.22
Biology:藏红花花被片中外泌体样纳米颗粒的表征及其免疫刺激活性
-
04.22
酵母建库技术全解析:从原理到实战,助你轻松构建高质量文库
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!










