小分子 大作用:十篇高分文献带你探索m6A的神秘力量
在RNA的世界里,隐藏着一种微小而强大的修饰,它被称为N6-甲基腺苷,简称m6A。m6A是一种RNA上的甲基化修饰,它可以出现在各种类型的RNA分子中,包括mRNA、tRNA、rRNA等。
多年来,研究者们对m6A进行了深入的探索,试图揭开它的神秘面纱。他们发现,m6A修饰在调控RNA的稳定性、转运、翻译和降解等方面发挥着关键作用。这个小小的化学标记在细胞的生命周期中扮演着不可或缺的角色,直接关系到基因表达、细胞命运的决定以及疾病的发生。与此同时,随着技术的不断进步,从最早的发现到高通量测序技术的应用,研究m6A的道路愈发清晰,硕果累累。
本文将带您回顾十篇m6A相关的高分文献,助您更好地理解m6A的生物学功能,以及它在健康和疾病中的潜在作用。
1、FMR1通过m6A修饰调控早期胚胎发育的分子机制

本研究发现在果蝇早期胚胎中FMR1可优先结合含有m6A修饰的“AGACU”motif的mRNA来调控母源mRNA降解,而FMR1能够识别和结合靶mRNA在很大程度上依赖于FMR1的KH2结构域内的疏水网络;更重要的是FMR1与含有m6A修饰的mRNA发生结合时,能够促进FMR1蛋白的相分离,进而在体内诱导FMR1颗粒的组装形成,同时促进FMR1颗粒对不含有m6A修饰mRNA的招募并完成母源mRNA的降解;而母源mRNA的降解又会导致FMR1颗粒的去组装,这样m6A可通过液-液相分离影响FMR1的RNP颗粒大小及活性来调控早期胚胎母源mRNA的降解从而在早期胚胎发育过程中实现对母源mRNA代谢的精确调控。总的来说,该研究揭示了FMR1通过m6A修饰调控果蝇早期胚胎发育的分子机制,同时也为研究核酸-蛋白颗粒调控早期胚胎发育的分子机制提供了新的思路。
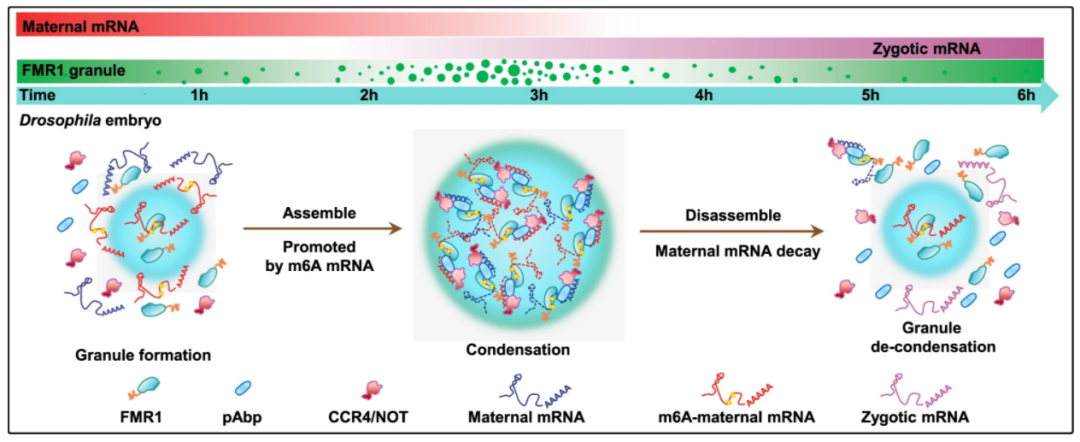 FMR1通过m6A调控果蝇早期胚胎母源mRNA降解的分子机制
FMR1通过m6A调控果蝇早期胚胎母源mRNA降解的分子机制
2、m6A阅读蛋白YTHDC1通过沉默逆转录元件调控细胞命运

该研究发现在小鼠胚胎干细胞中,RNA m6A通过其核内阅读器蛋白YTHDC1调控H3K9me3和异染色质形成,从而沉默逆转录转座子元件并限制该细胞转化为2C-like细胞。敲除Ythdc1或Mettl3均可导致逆转录转座子元件的重激活,并伴随SETDB1调控的H3K9me3修饰的大幅度下降,同时胚胎干细胞被重编程为2C-like细胞。这一工作发现RNA m6A指导染色质沉默的新功能,证明逆转录转座元件转录的RNA可以通过m6A-YTHDC1机制募集SETDB1到相关染色质区域并参与细胞命运调控。
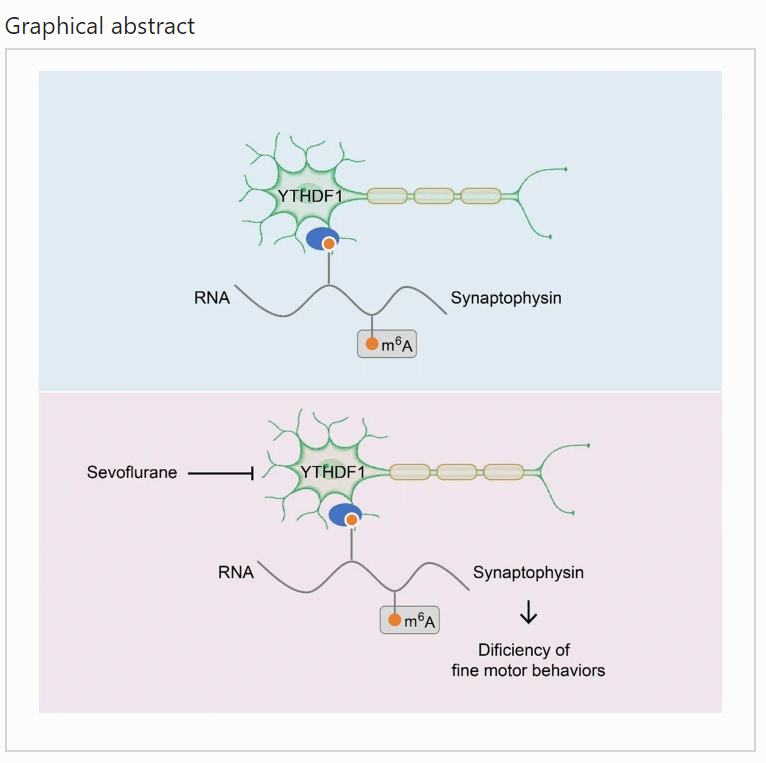
3、首次关注m6A甲基化在七氟烷麻醉影响精细运动损伤中的作用和机制

上海交通大学医学院附属第九人民医院麻醉科姜虹教授和中科院脑科学卓越创新中心仇子龙研究员在毒理学期刊 Cell Biology and Toxicology 上发表题为 Sevoflurane impairs m6A-mediated mRNA translation and leads to fine motor and cognitive deficits 的研究文章,该研究探索了全麻药物对婴幼儿精细运动能力损伤的机制,并首次关注了m6A甲基化在七氟烷麻醉影响精细运动损伤中的作用和机制,有望为预防或治疗全麻药的神经发育毒性提供新的思路。
4、mRNA m6A甲基化修饰参与少突胶质细胞发育以及中枢系统髓鞘形成

该研究利用小鼠模型选择性敲除不同发育时期的少突胶质细胞中m6A甲基化修饰蛋白(m6A writer),通过体内体外实验揭示了m6A甲基化标记在少突胶质前体细胞(oligodendrocyte precursor cells, OPCs)分化成熟为髓鞘形成细胞(myelinating oligodendrocytes),以及中枢神经系统髓鞘形成的过程中起着重要的作用。该研究进一步发现m6A标记显著影响不同发育阶段的少突胶质细胞的信使RNA剪接(mRNA alternative splicing),并且参与有髓鞘神经轴突信息传递的关键部位——郎飞结的形成。
5、m6A修饰调控TFH细胞分化的新机制

研究人员首先通过构建急性病毒感染模型以及蛋白免疫模型分析了METTL3在TFH细胞的分化和功能中的作用。进一步采用骨髓嵌合体和SMARTA细胞过继转移两个模型证明了METTL3细胞内源性调控TFH细胞的分化和效应功能。随后的研究发现METTL3调控早期TFH细胞的增殖、分化和存活。通过高通量测序数据结合低通量验证分析,发现多个与TFH细胞分化相关的基因上具有m6A修饰位点。其中,METTL3可以直接修饰TFH细胞分化关键基因Tcf7(编码转录因子TCF-1)的3' UTR区域。并且,m6A修饰主要通过调控Tcf7基因的稳定性来维持TCF-1蛋白的正常水平。进一步实验表明在缺失METTL3的细胞中过表达TCF-1可以回补TFH细胞分化的缺陷。该研究从RNA表观遗传修饰的角度出发,揭示了METTL3-m6A-TCF-1调控轴在TFH细胞分化过程中发挥重要作用。
6、Mettl3-m6A-Creb1作为内在的调节轴维持iNKT细胞库和功能分化
6月1日,中国农业大学生物学院于舒洋、清华大学徐萌、中国农业大学生物学院杜旭光团队合作在《细胞·报道》( Cell Reports )杂志上发表题为《Mettl3-m6A-Creb1作为内在的调节轴维持iNKT细胞库和功能分化》( Mettl3-m6A-Creb1 forms an intrinsic regulatory axis in maintaining iNKT cell pool and functional differentiation )的研究论文,揭示了Mettl3通过m6A依赖的方式调控Creb1的表达在iNKT细胞发育及功能分化过程中的关键调控机制。
7、METTL3介导的IGFBP7-OT m6A修饰通过调控DNMT1/DNMT3a-IGFBP7轴促进骨关节炎进展

马长艳教授课题组前期筛选了正常关节软骨和OA关节软骨组织中差异表达的lncRNAs和mRNAs,发现lncRNA IGFBP7-OT及其母基因IGFBP7 在OA软骨中显著高表达。进一步通过体内、体外实验发现IGFBP7-OT 主要通过减少DNA甲基转移酶DNMT1/3a与IGFBP7基因启动子的结合,从而上调IGFBP7的表达,进而加速了OA的进程。而RNA甲基转移酶METTL3介导的m6A修饰是造成IGFBP7-OT在OA中表达上调的主要原因之一。
该研究揭示了METTL3介导的IGFBP7-OT表达上调通过调控DNMT1/3a-IGFBP7轴在OA发生发展中的重要作用及机制,为OA的临床治疗提供了潜在靶点。

8、人源m6A甲基化酶复合物冷冻电镜结构

该研究首先体外获得了MACOM和MAC复合物,然后通过冷冻电镜解析了两套分辨率在3.0 Å的人源m6A甲基化酶调控亚基复合物MACOM的核心区域原子水平结构,以及整体分辨率为4.4 Å的人源m6A甲基化酶MAC-MACOM复合物整体结构。研究团队结合蛋白质-蛋白质和蛋白质-RNA交联质谱以及pull-down等生化实验与结构分析,阐明了MACOM复合物结构核心区域的组成及结构细节,并提出了MAC-MACOM甲基化修饰RNA的合理模型。
9、m6A调控 γδT细胞发育的机制

该研究表明ALKBH5介导的m6A mRNA修饰通过调节Jagged1/Notch2信号通路在胸腺T细胞早期发育和T细胞命运选择决定中发挥了重要的检查点作用,加深了我们对m6A在特定微环境和免疫细胞中生理学功能的理解,揭示了前体T细胞早期发育过程中的RNA表观遗传学调控机制。
10、人体和小鼠组织中m6A和m6Am修饰的分布和调控

本项研究中,作者通过对43个人体组织样本、16个小鼠组织样本和9种人类细胞系样本的全转录组m6A和m6Am测序及系统、全面的生物信息学分析,概括了其在人体和小鼠组织中的分布规律。该研究首次揭示了m6A和m6Am在脑组织具有较强的组织特异性。此外,m6A和m6Am修饰含量与其各自对应的修饰酶存在显著相关性;并且含有m6A的区域富集了大量潜在功能性SNP位点及microRNA靶向位点。该研究同时发现,在人体组织中m6Am修饰与蛋白表达水平呈负相关。跨物种的m6A和m6Am甲基化图谱分析揭示了m6A和m6Am修饰的物种特异性。综上,该项研究首次全面解析了人体和小鼠组织中m6A和m6Am修饰的分布规律和调控机制,为m6A和m6Am修饰的功能研究提供了重要依据。
当深入探索m6A修饰的奥秘时,我们也不禁思考:有哪些工具和技术可以帮助我们更全面地理解这个微小而强大的RNA修饰?
MeRIP(Methylated RNA Immunoprecipitation)技术就是其中之一,它使我们能够捕获和研究RNA上的m6A修饰,为RNA研究提供了更深层次的理解。
武汉金开瑞生物工程有限公司作为一家专业致力于为全球制药企业、诊断试剂企业、科研试剂研发企业、高校和科研院所以及大型医院提供蛋白及相关研究技术服务的高新技术企业,能够承接包括MeRIP在内的10余项分子互作技术服务。如果您对我们的技术服务有任何需求或疑问,请随时与我们联系。期待与您携手前行,一起在科研道路上取得更多的突破与成就。

参考文献:
1.https://doi.org/10.1038/s41467-022-28547
2.https://iobr.ynu.edu.cn/info/1018/1265.htm
3.https://baijiahao.baidu.com/s?id=1693267412804045199&wfr=spider&for=pc
4.https://www.nature.com/articles/s41586-021-03313-9
5.http://k.sina.com.cn/article_5803416260_159e91ac401900u9kz.html
6.https://link.springer.com/article/10.1007/s10565-021-09601-4
7.https://www.sci666.com.cn/30391.html
8.https://doi.org/10.1016/j.neuron.2019.12.013
9.https://news.cau.edu.cn/ttgznew/732148.htm
10.https://www.nature.com/articles/s41467-021-21594-6
11.https://news.cau.edu.cn/kxyj/1c83c07d0c4740b9857ea6d77033cbcb.htm
12.https://pubmed.ncbi.nlm.nih.gov/37267102/
13.https://doi.org/10.1016/j.celrep.2023.112589
14.https://jcyxy.njmu.edu.cn/2023/0706/c12049a241743/pagem.htm
15.https://www.nature.com/articles/s41422-022-00725-8
16.http://emba.ustc.edu.cn/2022/0929/c21841a572154/page.htm
17.https://www.shsmu.edu.cn/news/info/1003/22837.htm?PageSpeed=noscript
18.https://pubmed.ncbi.nlm.nih.gov/35939687/
19.http://www.pepge.pku.edu.cn/Index/scientific/cid/12/id/2443.html
20.https://doi.org/10.1016/j.molcel.2019.09.032
最新动态
-
01.29
技术跨界联用:表观遗传学进入“多维验证”时代,这些疾病机制再也藏不住了!文末有惊喜活动!
-
01.29
机制研究的金标准:金开瑞RIP/RNA pull-down试剂盒获多篇顶刊研究认可!
-
01.29
想测结合常数,但样本太珍贵?来试试MST技术
-
01.29
双荧光素酶实验,如何助力客户连发IF>10高分文章?揭秘我们的核心技术与成功案例!
-
01.29
传统草药新生命:鱼腥草来源外囊泡或成脑卒中治疗“绿色疗法”
-
01.29
FRONT PHARMACOL | 三七外泌体通过调控PI3K/AKT信号通路促进大鼠骨髓间充质干细胞的成骨分化
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图











