【干货】如何提升分子互作实验的实验技能?
人类疾病往往并非由容易追踪的单一基因变异导致,大多数疾病例如心脏病、癌症或者精神疾病都源自许多不同基因与彼此以及环境之间的复杂互动。分子互作研究(核酸与核酸、核酸与蛋白、蛋白与蛋白)是疾病机制研究的重要组成部分,是功能、表型研究的进一步深化。
蛋白质是生命体的重要组成部分,是生命活动的主要承担者和执行者。据估计,超过80%的蛋白质并不是孤立存在,而是与其他蛋白质通过相互作用形成稳定或瞬时的复合物结构。蛋白质-蛋白质相互作用(protein-protein interactions,PPIs)是分子生物学中最重要的现象之一,几乎在所有的生命过程中(如细胞通讯、代谢、转运、信号转导、免疫应答和基因转录)都起着核心作用。因此,对蛋白质-蛋白质相互作用的研究,已成为生命科学研究的热点之一。
研究蛋白质-蛋白质相互作用的常用实验技术包括GST pull down、Co-IP和酵⺟双杂交等,在之前的文章中已经对GST pull down和酵⺟双杂交进行了深入讲解,帮助大家更好地理解和运用这些技术手段。
一、Co-IP
1、技术原理
免疫共沉淀是利⽤抗体特异性反应纯化富集⽬的蛋⽩的⼀种⽅法。抗体与细胞裂解液或表达上清中相应的蛋⽩结合后,再与蛋⽩A/G(ProteinA/G)偶联的Agarose或Sepharose珠⼦孵育,通过离⼼得到珠⼦-蛋⽩A/G-抗体-⽬的蛋⽩复合物(若⽤MagBeads则通过磁⼒分离得到珠⼦-蛋⽩A/G-抗体-⽬的蛋⽩复合物),在⾼温及还原剂的作⽤下,抗原与抗体解离,收集上清,上清中包括抗体、⽬的蛋⽩和少量的杂蛋⽩。
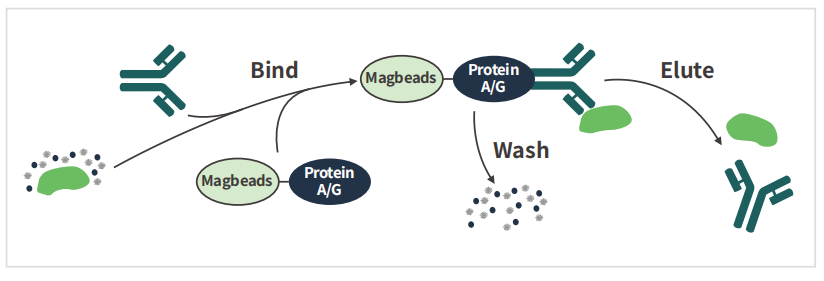
2、技术流程
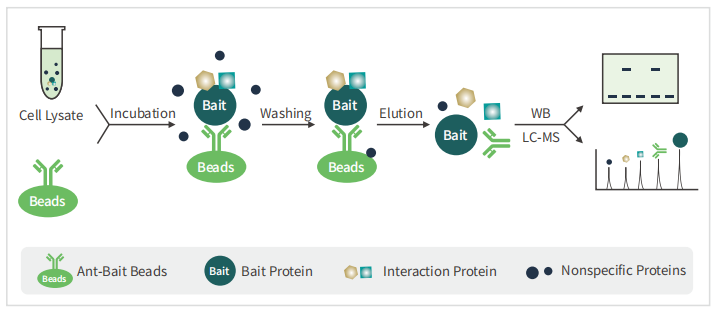
3、常⻅问题与解析
Q1:通过Co-IP后WB验证发现,没有想要的⽬的条带?
A1:1)有可能是样品被蛋⽩酶降解,对应的策略是需要添加蛋⽩酶抑制剂,所有操作保持4℃以下冰上操作并防⽌冻融。
2)有可能是抗体浓度太低导致条带较浅,则需要调整IP或WB抗体浓度,必要时设⽴浓度梯度,摸索最佳浓度。
3)抗体亲和⼒太低,选⽤适合于IP或者WB的抗体。
4)有的IP抗体未与磁珠结合,这种情况需选⽤适合IP的磁珠。
5)若Tag未暴露在融合蛋⽩构象的表⾯,则需改变Tag融合表达部位。
6)裂解液盐碱度太⾼,需⽤低盐碱度的裂解液。
7)抗体选择不当,更换抗体。
Q2:通过Co-IP后WB验证发现,虽然可⻅⽬的条带,但是背景很⾼,原因是什么?
A2:是由多方面原因造成的:
1)由于⾮特异蛋⽩结合导致背景⾼,若要避⾊⾮特异性蛋⽩结合,则需要在⽆⾎清溶液中裂解细胞,且在免疫沉淀前⽤protein(A/G)珠⼦预洗,在免疫沉淀后增加漂洗次数和盐碱度(⾼盐或去垢剂)。
2)实验仪器或试剂被污染,使⽤洁净的仪器及试剂。
3)转移膜上的⾮特异吸附导致背景⾼,实验操作过程中戴⼿套,使⽤镊⼦来取,不要接触膜转移⾯。
4)制备样品中可能有不完全溶解的⼤的蛋⽩复合体,则在制备样品后进⾏短暂超声处理(3次,每次5秒钟),然后离⼼,取上清后进⾏后续试验。
5)洗涤不彻底,则需要多次洗涤,并增加洗涤液中的NaCl和去垢剂浓度。
6)可能有⾮特异性蛋⽩吸附于珠⼦上,则须进⾏Preclearing以排⾮特异性吸附。
7)抗体本⾝待异性不好可能导致背景⾼,则须选择合适的抗体,可以考虑单抗。
8)使⽤了过多的细胞或组织进⾏裂解导致背景⾼,则须减少样本量,推荐100-500μg细胞裂解液。
9)蛋⽩降解也可能出现⾼背景的情况,尽量使⽤新鲜制备的样品。
蛋白质和核酸是组成生命的主要生物大分子,它们各自具有其结构特征和特定功能。核酸具有传递遗传信息等功能,而蛋白质则贯穿生命的所有生理过程。
蛋白质-核酸相互作用
生命科学是20世纪最重要的前沿研究领域之一,其重点在于了解各种生命活性物质的结构、功能及它们间的相互关系。蛋白质和核酸是组成生命的主要生物大分子,它们各自具有其结构特征和特定功能。核酸具有传递遗传信息等功能,而蛋白质则贯穿生命的所有生理过程。宏观上,两者的配合与作用构成诸如生长、繁殖、运动、遗传和代谢等生命现象的基础,其中涉及蛋白质-RNA相互作用的代谢过程主要包括RNA分子的转录、前体RNA的转录后处理、RNA在细胞内的转运与定位以及细胞内RNA的稳定化过程;涉及蛋白质-DNA相互作用主要包括基因的转录和调控、DNA的复制和修复、DNA的重组和包装以及染色质和核糖体的形成等。
研究蛋白质-RNA相互作用的常用实验技术包括RNA pull down和RNA 结合蛋⽩免疫沉淀(RIP),研究蛋白质-DNA相互作用则常使用电泳迁移率检测(EMSA)、染色质免疫共沉淀(ChlP)和DNA pull down技术。本期小编将以RIP和ChlP技术为例进行详细介绍。
二、RNA 结合蛋白免疫沉淀(RIP)
1、技术原理
RNA 结合蛋⽩免疫沉淀(RNA Binding Protein Immunoprecipitation,RIP)主要是运⽤针对⽬标蛋⽩的抗体把相应的RNA-蛋⽩复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进⾏q-PCR验证或者测序分析。
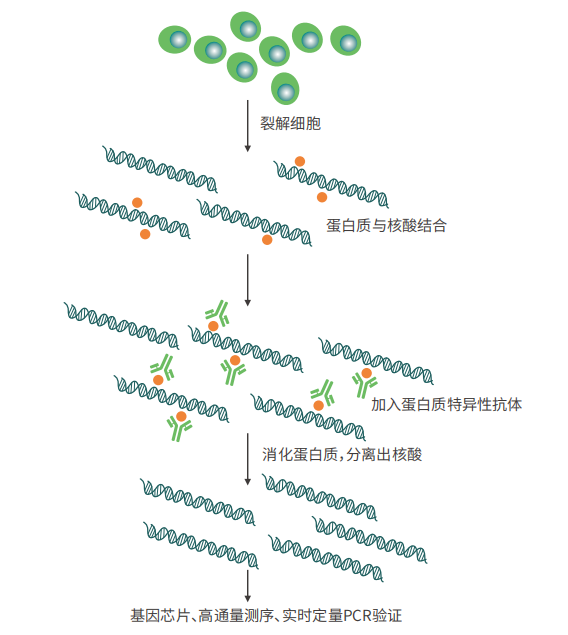
2、技术流程
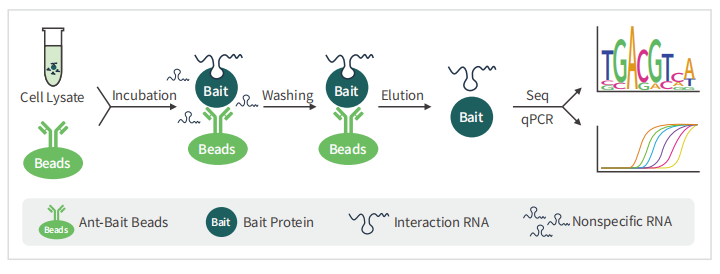
3、常⻅问题与解析
Q1:如何判断RIP实验成功?
A1:RIP后WB检测IP组和input组检测到⽬的蛋⽩信号即判断RIP实验成功。
Q2:IP和IgG样本Ct值没有差异
A2:多方面原因造成:
1)抗体没有富集到RNA,可更换抗体尝试;
2)IgG背景过⾼,可增加洗涤次数或减少免疫沉淀步骤RNA投⼊量。
Q3:溶解曲线异常
A3:出现⾮特异扩增或有引物⼆聚体等情况,需重新设计引物。
Q4:拉下样本RNA浓度过低
A4:1)样本投⼊量过少,考虑增加样本初始投⼊量;
2)裂解不完全,组织样本未研磨充分,或者⽤强裂解液进⾏裂解。
三、染色质免疫共沉淀技术(ChIP)
1、技术原理
染⾊体免疫共沉淀(Chromatin Immunoprecipitation,ChIP)是⽤来研究蛋白质与DNA是否在体内存在相互作用,这项技术帮助研究者判断在细胞核中基因组的某⼀特定位置会出现何种组蛋⽩修饰。利⽤抗体抗原特异性结合,将与目的蛋⽩相结合的DNA⽚段沉淀下来,能够真实地反映结合在DNA序列上的调控蛋⽩。
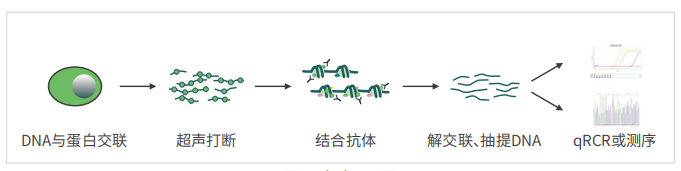
2、技术流程
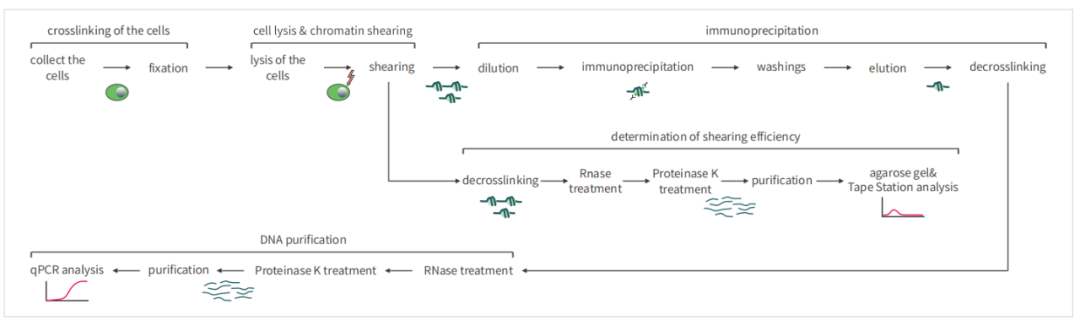
3、常⻅问题与解析
Q1:怎么探索超声条件
A1:接触式超声仪:取1.5mL/2mL EP管,加⼊1.2mL液体,将探头置于EP管中⼼,液⾯下约⼀半的位置,设置超声时间为10S,逐渐增加功率,直⾄开始起泡,此时功率为超声最⼤功率。在此基础上设置三个不同的功率梯度和时间梯度进⾏探索。⾮接触式:可按⼚家推荐进⾏探索。
Q2:超声后⽚段不符合要求
A2:1)有符合要求的⽚段也有⽐较集中⽆法超声的⼤⽚段,可能是交联温度过⾼,交联时始终保持温度低于25℃,尤其是夏天温度较⾼可将试剂和样本放置空调出⻛⼝⼀段时间再进⾏操作;
2)⽚段很集中且⼩于200bp,超声功率和时间不合适,需要做预实验探索最佳超声条件。
Q3:IP和IgG样本Ct值没有差异
A3:多⽅⾯原因造成:
1)抗体没有富集到DNA,可更换抗体尝试;
2)IgG背景过⾼,可增加洗涤次数或减少免疫沉淀步骤DNA投⼊量;
3)结合位点预测错误,需重新设计引物。
Q4:溶解曲线异常
A4:出现⾮特异扩增或有引物⼆聚体等情况,需重新设计引物。
Q5:样本DNA浓度很低,低于10ng/μL
A4:1)样本投⼊量过少:考虑增加样本初始投⼊量,尤其是肌⾁,⼼脏等;
2)裂解不完全:过度交联的样本或组织研磨不充分。如遇难裂解的细菌样本可在加⼊Lysis Buffer后-80℃反复冻融3次。
武汉金开瑞生物工程有限公司作为一家专业致力于为全球制药企业、诊断试剂企业、科研试剂研发企业、高校和科研院所以及大型医院提供蛋白及相关研究技术服务的高新技术企业,能够承接10余项分子互作技术服务,囊括核酸与核酸、核酸与蛋白、蛋白与蛋白之间相互作用的检测。此外,金开瑞生物还新推出多款小规格互作分析试剂盒,助您更快更好地研究和运用各类方法,欢迎采购~

最新动态
-
04.22
Biology:藏红花花被片中外泌体样纳米颗粒的表征及其免疫刺激活性
-
04.22
酵母建库技术全解析:从原理到实战,助你轻松构建高质量文库
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!













