【客户文献解读,IF>11】食管癌的"隐形推手":MALR-ILF3-HIF1a轴的强大作用
肿瘤相关巨噬细胞(TAM)是肿瘤微环境中数量最多的免疫细胞,对肿瘤的发生发展起到重要调节作用。作者发现了一种与巨噬细胞相关的长非编码RNA(lncRNA),名为MALR,它可以促进食管鳞状细胞癌(ESCC)的进展。TAM通过分泌TNFa上调ESCC细胞中MALR的表达,MALR可以通过激活HIF1a信号通路促进糖酵解和血管生成。在机制上,MALR与ILF3的dsRBD1结构域结合,促进ILF3蛋白的稳定性以及由ILF3介导的液-液相分离(LLPS),从而防止PARN介导的降解,提高HIF1a mRNA的稳定性。如果MALR缺失,基于细胞系的以及患者来源的异种移植肿瘤的生长会被抑制。在临床上,MALR的高表达与HIF1a靶基因的表达正相关,并预示着食管癌患者的预后不良。总的来说,这项研究揭示了MALR/ILF3介导的LLPS在肿瘤微环境重塑中的生理作用,突出了MALR-ILF3-HIF1a轴作为癌症治疗的潜在靶点。
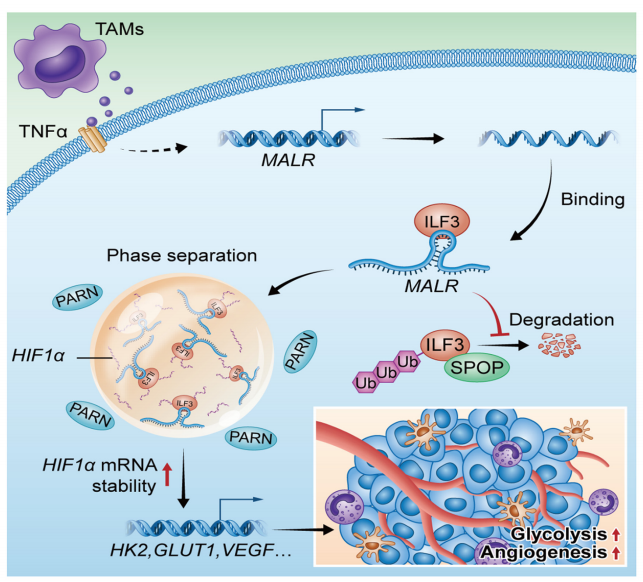
01 TAMs通过TNFa信号通路上调MALR的表达
作者首先从与TAMs共培养的ESCC细胞中分离RNA,并进行RNA-seq分析以确定TAM上调的lncRNA。通过比较与TAMs共培养的ESCC细胞和单独培养的ESCC细胞,确定了前20个TAM上调的lncRNA(图1A)。为了进一步缩小候选者范围,作者对ESCC肿瘤组织与其配对的正常组织(N=20)进行了RNA-seq分析,并确定了前20个在肿瘤组织中上调的lncRNA(图1B)。在上调的lncRNA中,只有一个候选者在两组中均出现,这个lncRNA被命名为MALR。
通过qRT-PCR分析,证实了MALR在ESCC组织(图1C)以及与来自患者的TAMs、M2型巨噬细胞或THP-1细胞共培养的ESCC细胞(KYSE150和TE-11)中上调(图1D-F)。相关性分析显示,ESCC肿瘤组织中MALR的表达与CD68的表达呈正相关,CD68被认为是巨噬细胞的一种特异性标记(图1G)。此外,ESCC患者中MALR高表达者总体生存率和无病生存率较差(图1H和I),这表明MALR是ESCC潜在的预后生物标志物。此外,当与TNFa敲低的TAMs共培养或用中和抗体阻断TNFa时,肿瘤细胞中MALR的上调没有发生显著变化(图1K;补充图S1I),这表明TNFa是导致TAMs诱导MALR表达的主要炎症细胞因子。综上,这些结果表明TAMs通过TNFa信号通路上调MALR的表达。
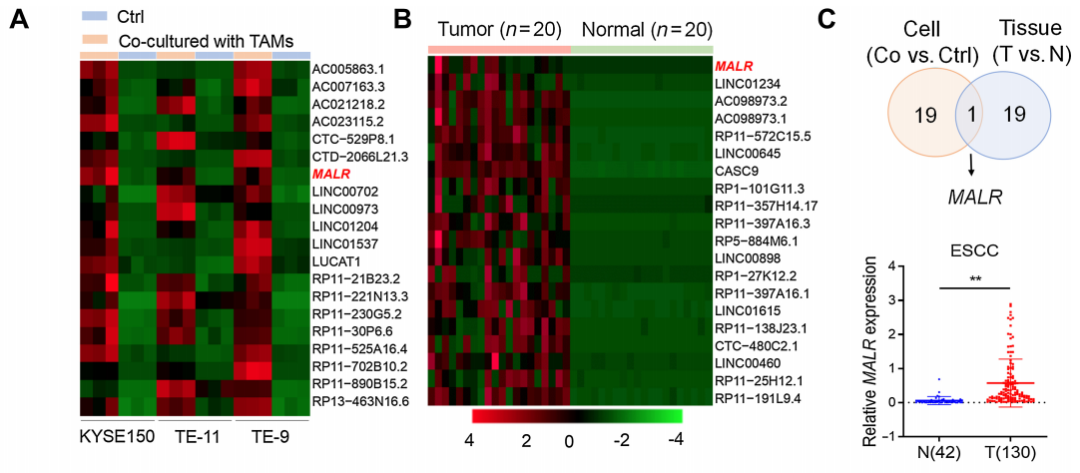
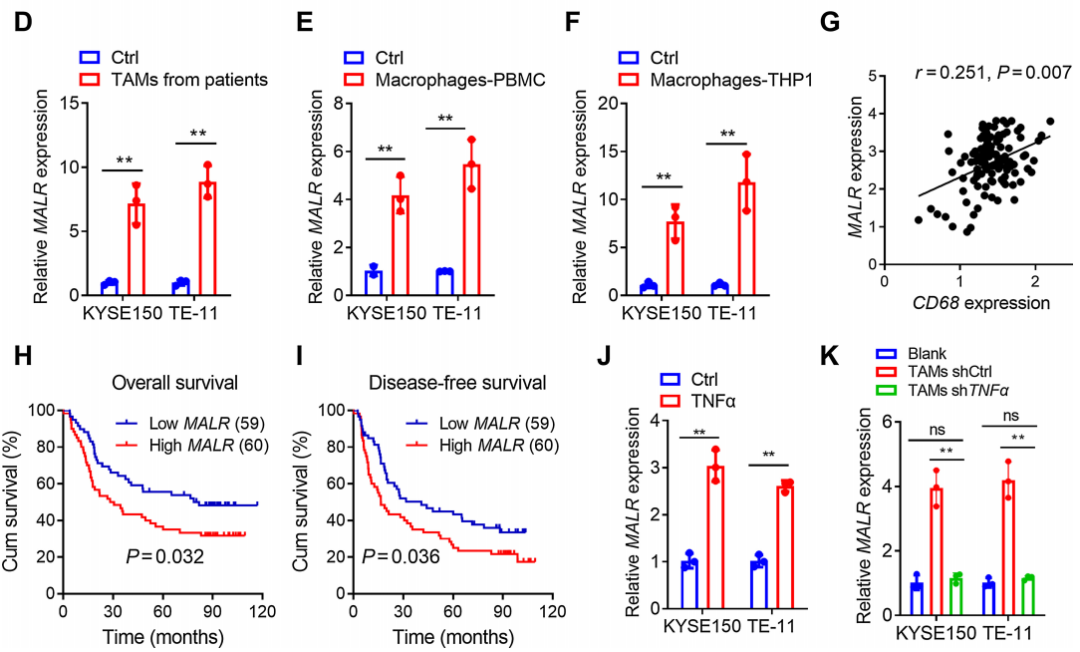
图1. MALR通过TAMs分泌的TNFa上调
02 MALR通过激活HIF1a通路促进ESCC细胞的恶性表型
考虑到MALR可能参与ESCC的恶性发展,作者在两个高表达MALR的细胞系中(TE-15和TE-9)构建了MALR敲除(KO)的ESCC细胞,并进行了RNA-seq分析以确定受MALR调节的靶基因。热图结果表明,在两种ESCC细胞系中,当MALR敲除后HIF1a的表达显著下调(图2A)。据报道,HIF1a在缺氧条件下调控许多基因以刺激糖酵解代谢和血管生成。对TCGA数据的基因集富集分析表明,MALR高表达与缺氧、糖酵解和血管生成呈正相关(图2B)。qRT-PCR分析显示,在缺氧条件下培养的MALR敲除细胞中,HIF1a靶基因的转录显著减少(图2C),这一点也得到了免疫印迹(IB)分析的证实(图2D)。这些数据表明MALR在癌细胞中可能激活HIF1a信号通路。
MALR的缺失显著削弱了ESCC细胞在缺氧条件下培养时的糖酵解活性和细胞生长(图2E和F;补充图S2B)。VEGF是癌症中关键的促血管生成因子,对癌症进展至关重要。正如ELISA所证实的那样,在缺氧条件下培养24小时后,MALR的缺失显著降低了培养基中VEGF的分泌(图2G)。此外,当人脐静脉内皮细胞(HUVEC)在从MALR敲除细胞获得的培养基中培养时,管状形成能力显著受损(图2H)。TNFa刺激显著增强了ESCC细胞在缺氧条件下培养时的糖酵解活性、细胞生长和管状形成能力,而这种作用可被MALR敲除所减弱(图2I-K)。综上所述,这些数据表明MALR表达与HIF1a激活之间存在强相关性,并强调了MALR在重编程癌细胞代谢和促进血管生成中的潜在作用。
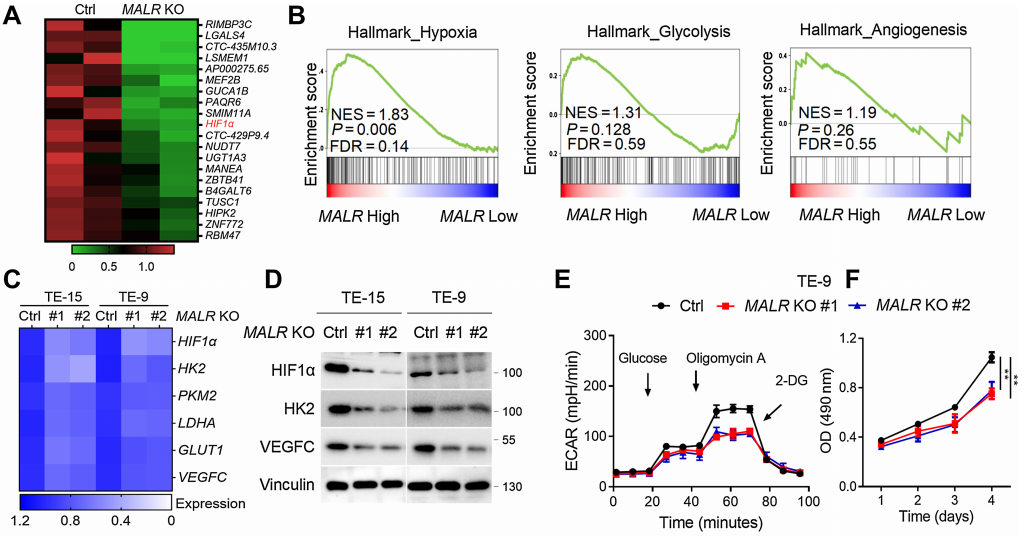
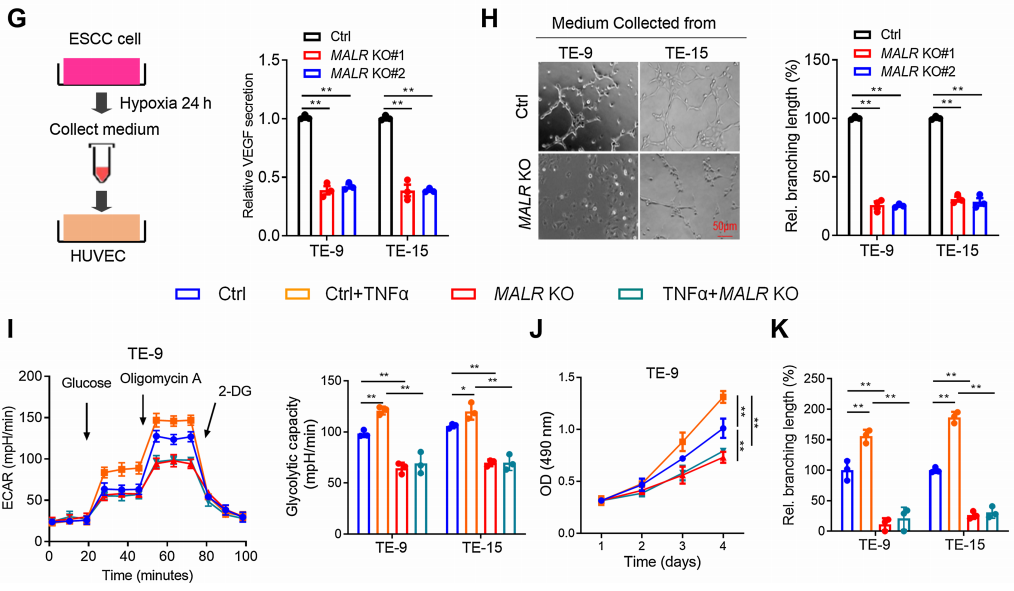
图2. MALR通过激活HIF1a通路促进ESCC细胞的恶性表型
03 ILF3与MALR结合并经历LLPS
接下来,作者通过FISH检测和MALR的亚细胞定位发现MALR主要定位于细胞核(图3A和B;补充图S3A)。为了探究MALR在肿瘤进展中的潜在作用和机制,作者进行了RNA pull-down分析,随后通过MS鉴定了与MALR相关的蛋白质,如之前报道的那样,特异性与ILF3结合是正义MALR,而不是反义MALR(图3C)。MALR与ILF3之间的特异性相互作用也通过RIP实验得到证实(图3D;补充图S3B)。进一步的MTRAP实验表明,与阴性对照相比,MS2-MALR和MCP-3FLAG质粒的共表达导致ILF3的明显富集(图3E)。作者还通过ChIRP分析在体内验证了MALR与ILF3的相互作用(图3F)。
此外,作者进行了CLIP-PCR分析,并鉴定了MALR的T3片段介导了MALR与ILF3的相互作用(图3G)。通过进行ILF3蛋白序列的生物信息学分析,作者发现ILF3的C端高度无序,并包含IDRs(图3H)。研究表明IDRs经常出现在相分离的隔室中,因此作者推测ILF3分子有可能发生LLPS。为了评估与MALR的相互作用是否诱导ILF3发生LLPS,作者将EGFP-ILF3蛋白(绿色)与Alexa Fluor 546-14-UTP标记的MALR(红色)混合。混合后,ILF3和MALR形成了微米大小的液滴(图3I),这在ESCC细胞中通过FISH和IF检测也观察到了(图3J)。FRAP分析进一步证明了ILF3介导的LLPS的动力学特性(图3K;补充影像S1)。如FRAP分析所示,液滴动态地改变,分子在液滴与周围溶液之间进行交换(图3K;补充影像S1)。综上所述,这些结果表明ILF3蛋白能够发生LLPS。
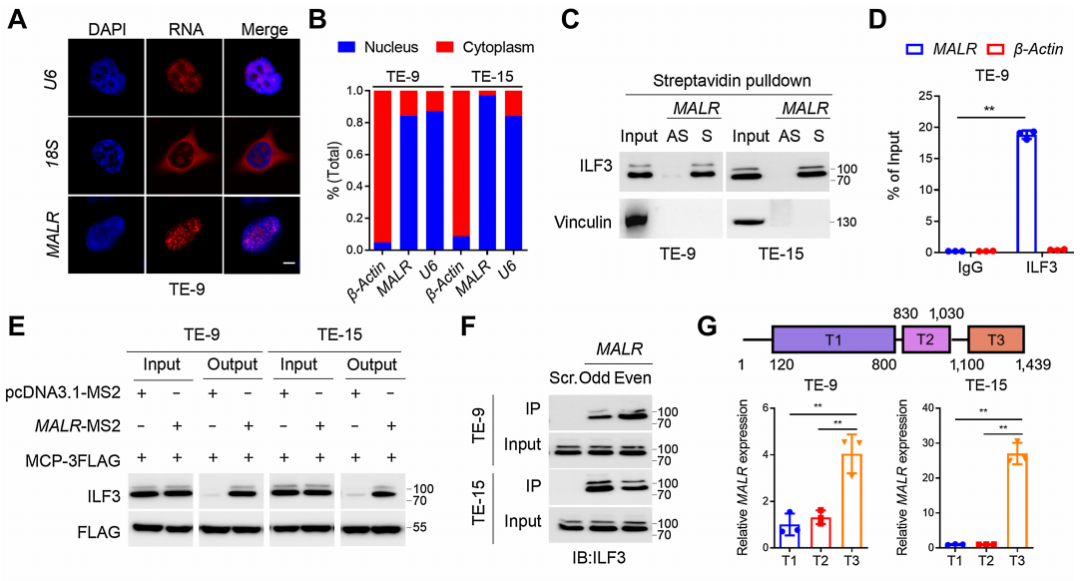
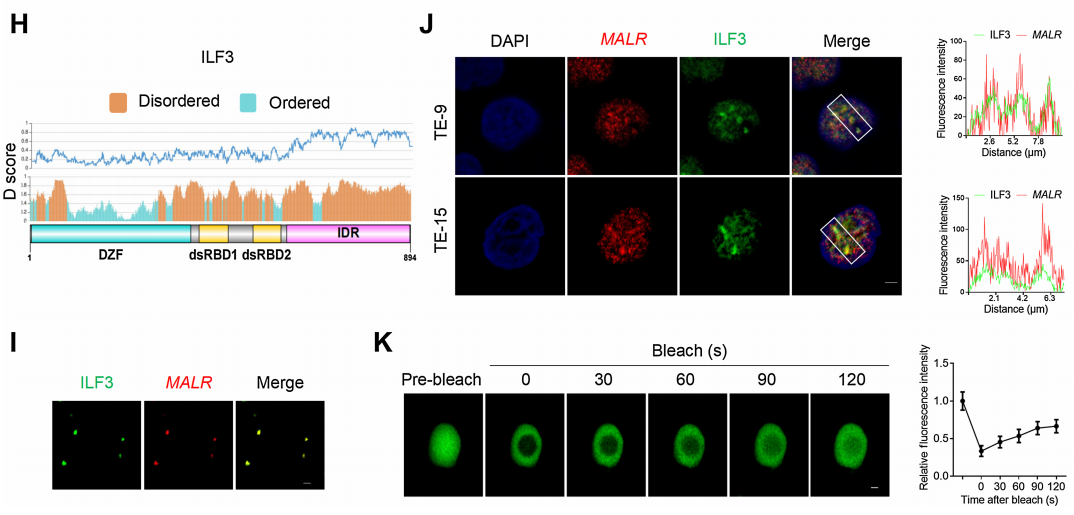
图3. ILF3与MALR结合并经历LLPS
04 MALR促进ILF3蛋白的稳定性和ILF3介导的LLPS
随后,作者评估了MALR-ILF3相互作用对ILF3稳定性的功能效应。作者发现在ESCC细胞与巨噬细胞共培养或用TNFa处理后,ILF3的表达增加(图4A;补充图S4A)。具体来说,MALR KO ESCC细胞中ILF3的表达明显减少,但通过蛋白酶体抑制剂MG-132处理可以恢复(图4B),这表明MALR促进ILF3的稳定性。此外,敲除MALR对ESCC细胞中ILF3的稳定性有显著影响,缩短了ESCC细胞中ILF3的半衰期(图4C和D;补充图S4B)。此外,作者在用FLAG标签标记的ILF3表达的细胞中进行了IP试验,用抗FLAG抗体进行IP检测,并通过IB法检测了泛素水平。结果显示,MALR敲除显著增加了泛素化ILF3的水平(图4E)。这些数据表明,MALR是维持ILF3稳定所必需的。为了找出与MALR相互作用所需的ILF3蛋白的结构域,作者测试了几种截短的ILF3蛋白形式并发现ILF3的dsRBD1片段在TE-9细胞中是必需的(图4F)。综上所述,ILF3的dsRBD1片段是MALR-ILF3相互作用和包括ILF3蛋白稳定性、细胞生长在内的关键功能所必需的。
之前的研究表明,SPOP是一种E3泛素连接酶,通过与dsRBD1片段附近的结构域的物理相互作用来调节ILF3蛋白的稳定性。基于这一发现,作者通过Co-IP实验观察到敲除MALR显著增强了ILF3与SPOP之间的相互作用(图4G),这一结果也得到了Duolink PLA实验的证实(图4H;补充图S4H)。因此,作者的数据表明MALR通过阻止SPOP介导的泛素化来增加ILF3蛋白的稳定性。当ILF3-EGFP蛋白浓度为0.1mmol/L时,在不存在MALR的情况下观察到了液滴的形成(图4I)。此外,正交实验表明ILF3的相分离依赖于MALR的剂量。在存在MALR的情况下,相同蛋白浓度下液滴形成能力显著增强(图4I)。为了进一步探讨MALR对ILF3相分离的影响,作者在ESCC细胞中过表达MALR,发现显著增加了ILF3点状形成(图4J)。MALR KO ESCC细胞中ILF3点状形成受到抑制,这可以通过重新表达FL-MALR来挽救,而在DT3-MALR过表达组中则不是这样(图4K)。这些结果表明,MALR(尤其是T3片段)促进ILF3介导的LLPS形成并促进肿瘤生长。
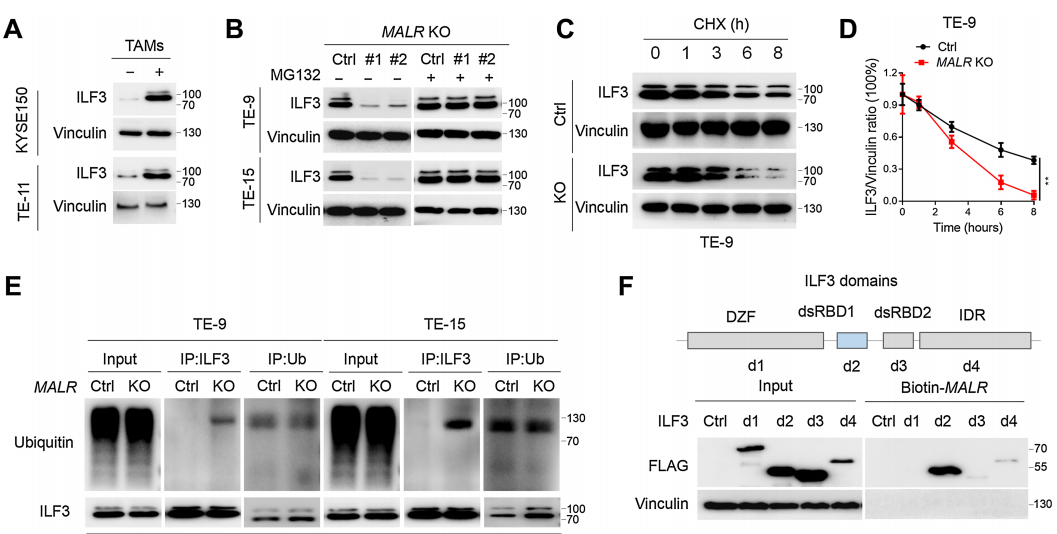
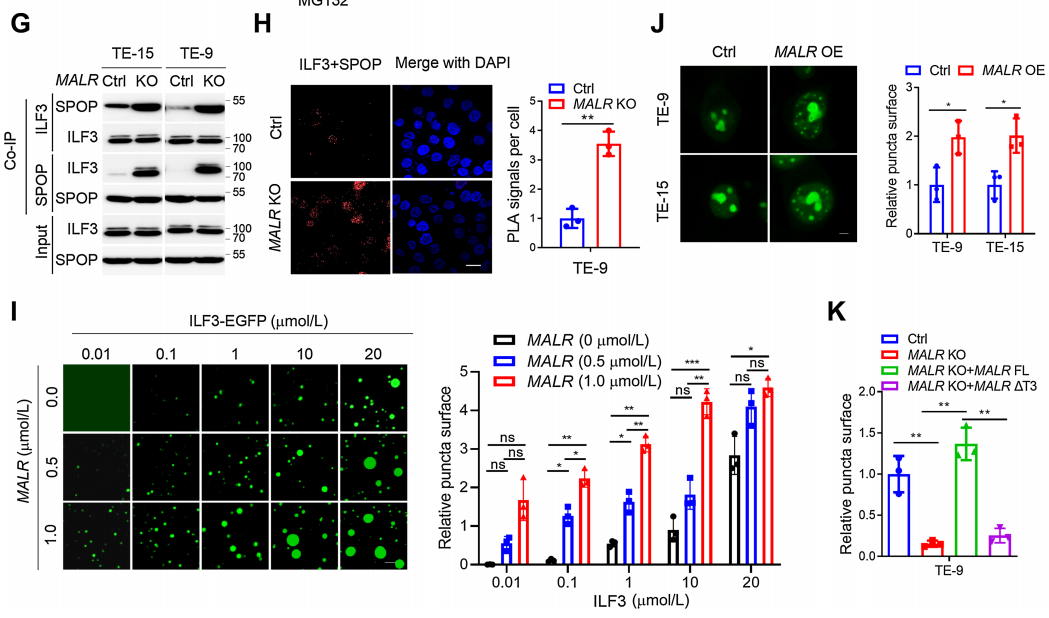
图4. MALR促进ILF3蛋白的稳定性和ILF3介导的LLPS
05 MALR-ILF3介导的LLPS增加了HIF1a mRNA的稳定性
Actinomycin D是一种广泛用于测量mRNA降解率的转录抑制剂,在ESCC细胞中,MALR的缺失降低了HIF1a mRNA的稳定性,而在这些细胞中加入Actinomycin D(图5A;补充图S5B)后也是如此。相反,TNFa处理显著增强了HIF1a mRNA的稳定性,这可以通过在ESCC细胞中敲除MALR来挽救(图5B;补充图S5C)。此外,在MALR KO ESCC细胞中,HIF1a mRNA的稳定性降低可以通过外源性表达WT-ILF3来挽救,但不能通过DIDR-ILF3或DdsRBD1-ILF3来挽救(图5C;补充图S5D)。在MALR KO细胞中,HIF1a mRNA的稳定性降低不能通过与1,6-HD一起使用的WT-ILF3来挽救,却可以通过与对照2,5-HD处理一起使用的WT-ILF3来挽救(图5D;补充图S5E和S5F)。综上所述,这些数据表明MALR-ILF3介导的LLPS在促进HIF1a mRNA稳定性方面起着至关重要的作用。
如图5E所示,作者推断ILF3介导的LLPS可能阻止HIF1a mRNA与PARN之间的相互作用。敲除MALR显著增加了HIF1a mRNA与PARN的相互作用,这通过RIP-PCR测定得到证实(图5F)。作者进一步测试了ILF3 KO ESCC细胞中HIF1a mRNA与PARN的相互作用,RIP-PCR测定表明,敲除ILF3显著增强了HIF1a mRNA与PARN的相互作用,这可以通过在ESCC细胞中过表达shRNA抗性的WT-ILF3来挽救,但不能通过过表达DIDR-ILF3或用1,6-HD处理来挽救(图5G)。总的来说,这些数据表明,MALR-ILF3介导的LLPS通过防止PARN介导的识别和衰变来维持HIF1a mRNA的稳定性。
为了进一步研究MALR促进的ILF3相分离对肿瘤细胞恶性行为的影响,作者在MALR KO ESCC细胞中过表达了WT-ILF3或DIDR-ILF3(图5H)。作者发现,在缺氧条件下培养的MALR敲除细胞中,WT-ILF3的过表达显著挽救了HIF1a下游分子表达、ILF3点状形成、糖酵解活性、细胞生长和管状形成,但在DIDR-ILF3过表达组中则不是这样(图5H-L)。这些结果表明,MALR-ILF3介导的LLPS促进ESCC的体外恶性进展。
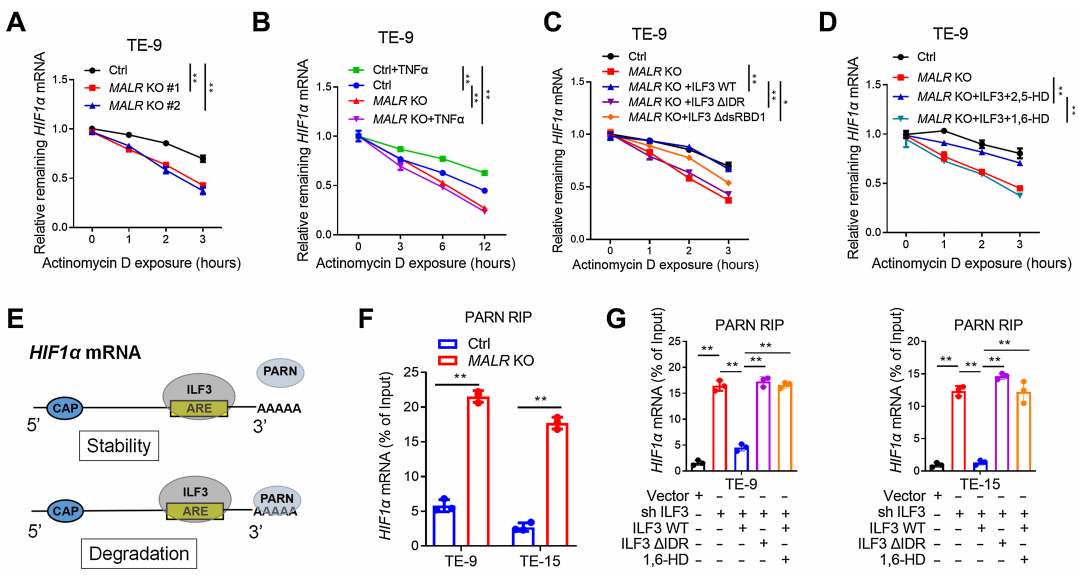
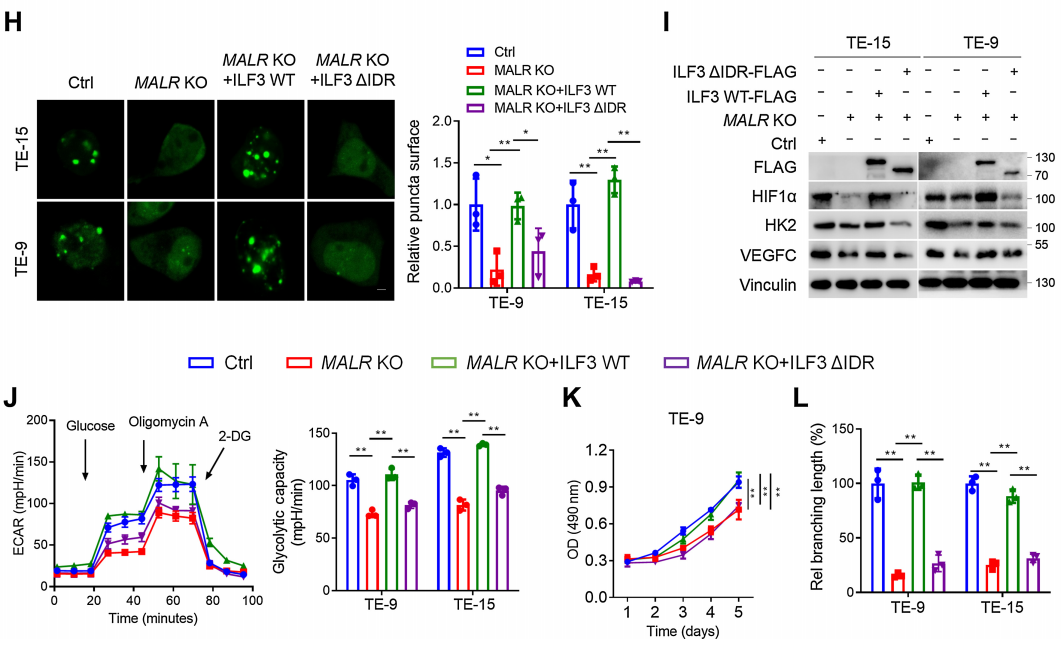
图5. MALR-ilf3介导的LLPS维持了HIF1a mRNA的稳定性
06 MALR-ILF3介导的LLPS促进ESCC的恶性进展
接下来,作者研究了MALR-ILF3-HIF1a轴在体内肿瘤发生中的作用。如图6所示,在ESCC细胞中下调MALR或ILF3显著降低了基于细胞的异种移植肿瘤的生长(图6A和B;补充图S6A和S6B)。此外,Ki-67和CD31(内皮细胞标记)也表明,细胞增殖和血管生成也减少(图6C;补充图S6C)。作者通过IHC和IF染色检测还证实,在异种移植肿瘤组织中,HIF1a表达和ILF3点状形成在MALR或ILF3敲除后显著减少(图6C;补充图S6C)。这些数据与作者在体外的发现一致。作者按照先前报道的方法将ESCC细胞和巨噬细胞注射到NSG小鼠中,增加了异种移植肿瘤的生长、增殖、血管生成和ILF3点状形成,这可以通过在巨噬细胞中消耗TNFa以及在ESCC细胞中消耗MALR或ILF3来消除(图6A-C;补充图S6A-S6C)。值得注意的是,使用MALR抑制剂敲除MALR可显著降低肿瘤生长、血管生成和ILF3点状形成(图6D-H;补充图S6F)。综上所述,这些结果表明MALR在ESCC发展中具有促肿瘤作用。
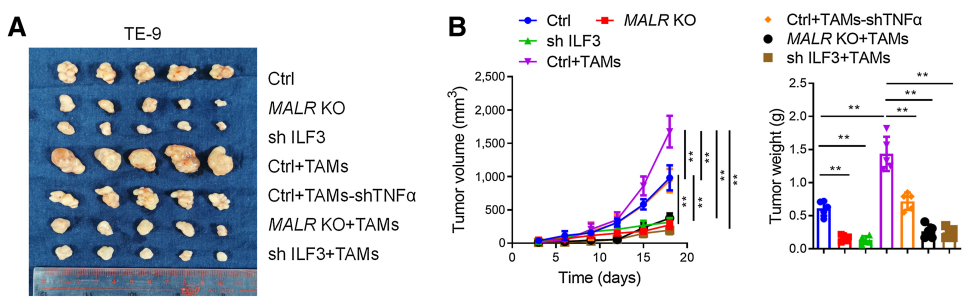

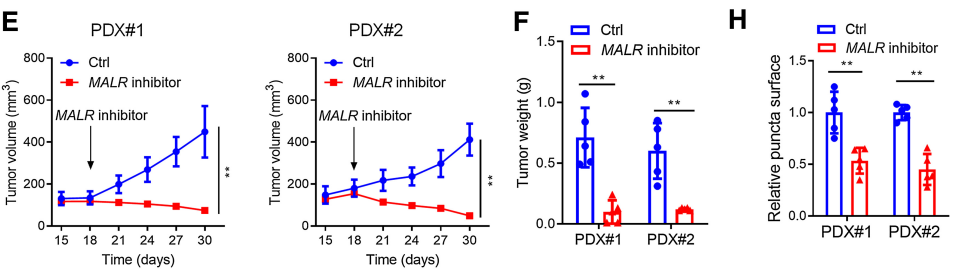
图6. MALR-ilf3介导的LLPS促进体内肿瘤生长
07 ESCC患者中MALR-ILF3-HIF1a轴的临床相关性
为了确定MALR及其上游或下游基因的表达与临床的相关性,作者检查了人类ESCC组织中的它们的表达谱。通过qRT-PCR检测了MALR的表达,并根据中位数表达水平将样本分为MALR-low和MALR-high组。作者进一步通过IHC分析在ESCC组织队列中检查了MALR与TAM标记物(CD68)、肿瘤细胞增殖标记物(Ki-67)和血管生成标记物(CD31)的表达水平之间的相关性(图7A)。MALR-high组表现出较高的CD68、ILF3、HIF1a、Ki-67和CD31表达,而MALR-low组表现出相反的模式(图7B)。值得注意的是,MALR的表达与ESCC组织中ILF3点状的数量呈正相关(图7C)。此外,MALR的表达与HIF1a及其下游基因在ESCC样本中的表达呈正相关(图7D和E)。总之,这些数据表明MALR-ILF3-HIF1a轴在人类癌症的发展中起着重要的作用(图7F)。
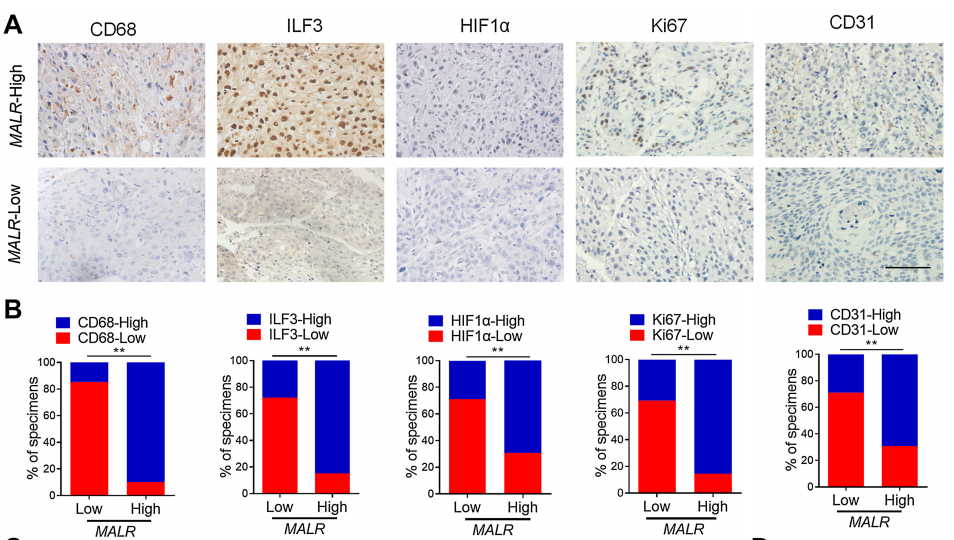
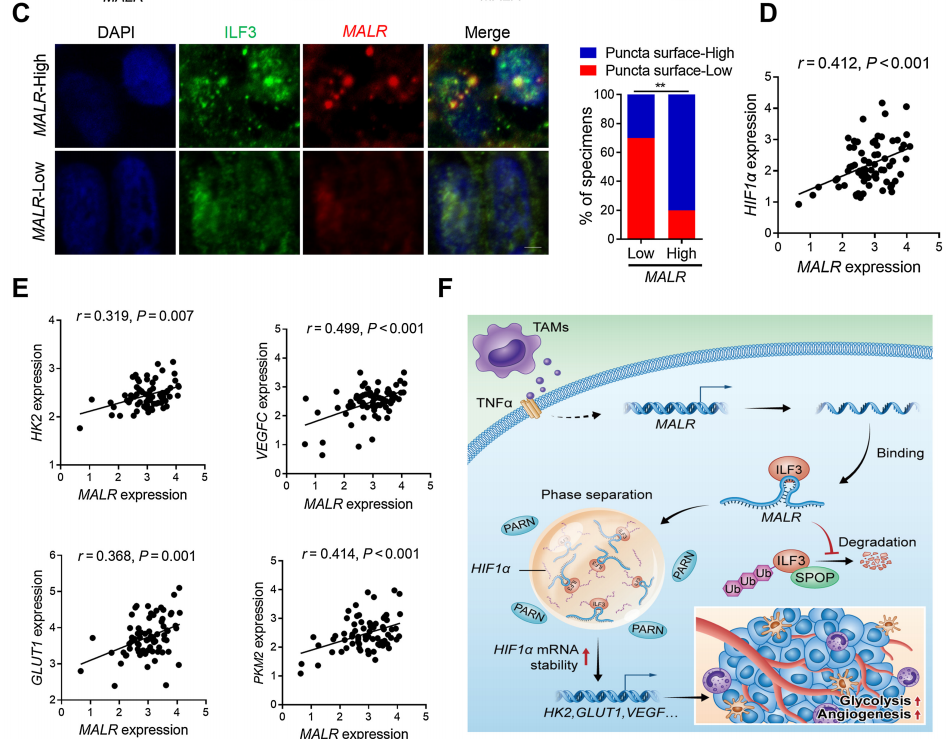
图7. ESCC患者中MALR-ILF3-HIF1a轴的临床相关性
小结
本研究发现lncRNA MALR在食管癌中发挥关键作用。TAMs通过分泌TNFa上调MALR,进而促进糖酵解和血管生成。MALR与ILF3结合增强HIF1a信号通路,促进肿瘤进展。在临床样本中,MALR的高表达与不良预后相关。因此,MALR-ILF3-HIF1a轴可能成为治疗食管癌的潜在靶点。
最新动态
-
06.27
Foods | 黑果枸杞类外泌体提取工艺优化及其对HT22细胞中AB诱导的细胞凋亡和氧化应激的抑制作用
-
06.23
科研小白必看的Co-IP结果解读
-
06.19
史上最全的ATAC-seq实验技术详解
-
06.19
INT J NANOMED | 源自鹿茸间充质干细胞的外泌体可以促进伤口愈合
-
06.19
Nutrients |葱衍生的外泌体样纳米颗粒可防止谷氨酸触发的铁性细胞死亡
-
06.09
表观遗传学”新宠“ - CUT&Tag技术
-
06.09
蛋白互作研究利器:Co-IP实验的核心要点
-
06.09
Int J Nanomedicine|连翘来源外泌体:一种用于有效肿瘤光动力治疗的新型天然光敏剂
-
06.09
Food Science & Nutrition |石榴来源的外泌体样纳米囊泡在脂肪性肝病中的治疗潜力
-
05.21
【避坑指南】EMSA实验全攻略 梯度探针设计










