BIFC蛋白互作实验步骤和技术详解!
双分子荧光互补(BimolecularFluorescent Complimentary, BiFC)技术是指通过具有相互作用亲和力的两个蛋白质,将分别与其相连的荧光蛋白片段拉近,组装成完整的荧光蛋白,从而表征蛋白质相互作用的发生及其空间位置。
当蛋白质A与蛋白质B在细胞内发生相互作用时,它们各自的荧光蛋白片段也会随之靠近,形成完整的荧光蛋白构象。这种构象恢复使得荧光蛋白能够发出特征荧光,从而在显微镜下可视化地反映出蛋白质A与B的相互作用。
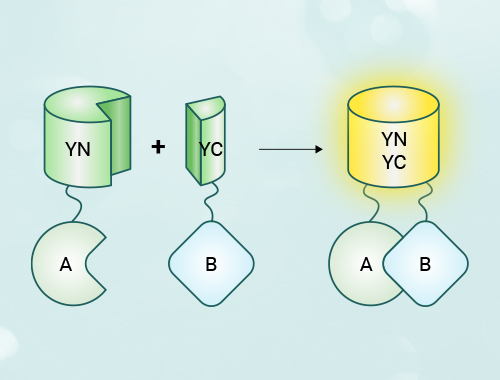
双分子荧光互补验证蛋白互作的原理图
BIFC实验流程
● 构建融合蛋白:设计并合成针对目标蛋白A和B的特异性引物,将其分别与荧光蛋白N端和C端片段基因融合,构建相应的表达载体。
● 细胞转染:将含有融合蛋白A-N端和B-C端片段的载体同时或分别转入感兴趣的细胞系,实现融合蛋白的共表达。
● 荧光观察:转染后一段时间(通常24-48小时),使用荧光显微镜或共聚焦显微镜观察细胞,若观察到绿色(或对应荧光蛋白颜色)荧光信号,说明蛋白质A和B发生了相互作用。
BIFC技术优势
● 活细胞内检测:能够在细胞生理状态下直接观察蛋白质相互作用,保留了时空动态信息。
● 高特异性:只有当目标蛋白相互作用时,荧光信号才会出现,减少了假阳性结果,提高了检测的特异性。
● 多色标记:通过使用不同颜色的荧光蛋白对,可同时检测多个蛋白质相互作用,实现多维度、多层次的蛋白质互作网络研究。
● 直观且定量:通过荧光强度衡量互作程度,可以通过荧光强度定量分析软件进行半定量或定量评估,为研究蛋白质互作的动态变化和强度提供直观且量化的数据。
● 适用于多种生物体系:广泛适用于动物、植物、微生物等生物体系,在植物研究中,尤其适用于研究蛋白质在特定细胞器、细胞结构或特定生理条件下的互作。
● 检测弱或瞬时相互作用:对低亲和力、短暂相互作用敏感,能够揭示一些传统方法难以检测到的相互作用。
BIFC技术应用
● 蛋白质互作网络研究:揭示复杂信号通路中蛋白质间的直接相互作用。
● 细胞内定位与动态研究:观察蛋白质相互作用在细胞内的空间分布及其随时间的变化。
● 药物筛选与验证:检测候选药物对特定蛋白质相互作用的影响,评估其生物活性。
● 植物科学:研究植物生长发育、逆境响应、信号传递等过程中的关键蛋白质互作。
● 神经科学:揭示神经元间或神经元内部蛋白质的相互作用,如突触形成、神经递质释放、离子通道调控等。
● 癌症研究:研究致癌基因与抑癌基因、癌蛋白与微环境因素的相互作用,揭示癌症发生发展的分子机制,为诊断、预后评估和个性化治疗提供依据。
BIFC实验优化与注意事项
● 融合片段选择:选择对荧光蛋白功能影响较小的片段融合位点,确保片段重组后荧光蛋白功能恢复。
● 荧光蛋白选择:考虑荧光蛋白的亮度、稳定性、光谱特性等因素,选择最适合实验条件的荧光蛋白。
● 对照设置:包括阴性对照(表达单个荧光蛋白片段的细胞)和阳性对照(已知存在相互作用的蛋白质对)。
● 转染效率与表达水平监控:确保细胞转染效率足够高,且融合蛋白表达水平适中,避免过表达干扰。
BIFC实验设计与结果解读

如上图所示,BiFC系统包含两个质粒,一个质粒上带有到YFP蛋白的N端173个氨基酸,另一个质粒上带有YFP蛋白C端155个氨基酸。将待测蛋白A和B分别构建到两个载体上,与YFP的N部分和C部分分别融合表达,如果A和B蛋白能够结合,则YFP的两个部分也能重新组合在一起发出荧光。载体上分别带有Myc标签和HA标签,供WB验证。
结果解读
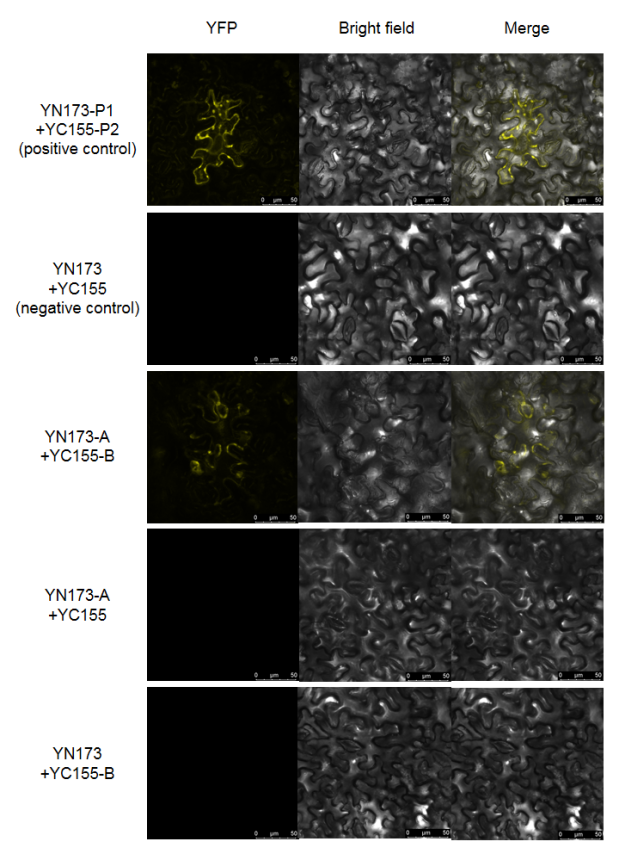
转染烟草后拍照检测
● 默认分组方式如上图所示,每组每个视野都会拍摄荧光、明场以及融合3张照片;
● “YN173-P1 + YC155-P2”为阳性对照,“P1”和“P2”是已知能够互作的蛋白;
● “YN173 + YC155”为阴性对照,转染的一对空载质粒,不会检测到荧光;
● “YN173-A + YC155-B”为实验组,“A”和“B”指代待验证是否互作的一对蛋白,在阴阳性对照正常的情况下,如果实验组能检测到荧光,说明两个蛋白能够互作,反之说明两个蛋白不能互作;
● “YN173-A + YC155”和“YN173 + YC155-B”为单分子对照组,同阴性对照不会检测到荧光。
● 由于融合表达蛋白空间构象的问题,有时在没有检测到互作的情况下,调换两个蛋白的BiFC载体重新验证,又能够检测到互作。
最新动态
-
12.24
导师压箱底的DNA pull down实验全流程拆解!
-
12.24
从靶点发现到药物验证:SPR +CoIP +ChIP+双荧光+pull down共同验证雷公藤红素如何为胰腺癌提供全新治疗线索?
-
12.24
REGEN BIOMATER| 首次揭示-红景天来源纳米囊泡在血管再生治疗中的突破性进展!
-
12.10
文献阅读:一分钟教你看懂火山图
-
12.10
RNA-蛋白互作研究全景解析:从circPOLR2A案例看机制探索之路
-
12.10
神奇的“植物外泌体”?铁皮石斛衍生的纳米囊泡登顶顶刊,揭示皮肤再生新密码!
-
11.20
Journal of Pharmaceutical Analysis | 生姜外泌体作为姜黄素递送系统在治疗溃疡性结肠炎中的应用
-
11.20
J Nanobiotechnology | 叶酸修饰的生姜衍生的细胞外囊泡可以重塑免疫微环境,靶向治疗类风湿性关节炎
-
11.20
WB实验翻车无数次?可能从一开始,你的抗体就选错了!
-
11.20
从“核心”到“网络”:如何以已知基因为锚点,绘制其上下游通路图谱!










