分子互作技术:植物胁迫研究的有力工具
在大自然的辽阔画卷中,植物以惊人的生命力与智慧,书写着与环境抗争的不朽篇章。为了在这些不利条件下(如干旱、盐碱化、极端温度以及病虫害等)生存与繁衍,依赖于一系列生物化学反应和信号传递过程的紧密配合,植物进化出了复杂而精细的应对机制。这些机制不仅确保了植物个体的存活,还维持了生态系统的平衡与多样性。因此,对植物胁迫的深入研究不仅有助于我们更好地理解植物的适应性机制,还为农业技术创新和作物改良提供了宝贵的科学依据和技术支撑。
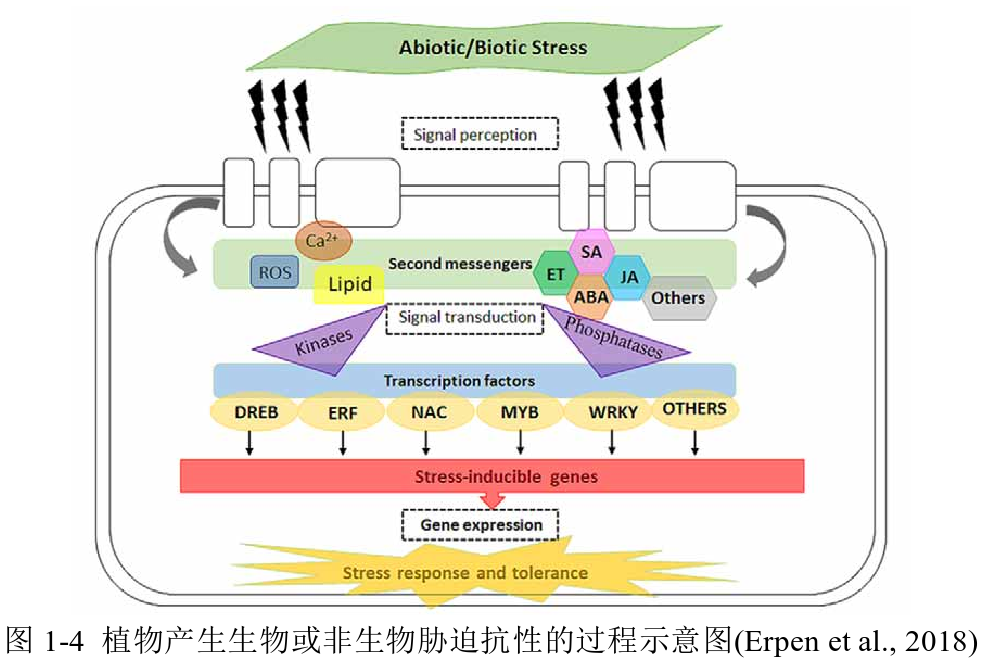
图源:https://www.cnki.net/
植物面临的挑战可以大致分为两类:生物胁迫与非生物胁迫。生物胁迫源自其他生物的直接干预,如病原体的感染、害虫的侵袭、杂草的竞争以及动物的啃食;而非生物胁迫则源于环境的物理或化学因素,比如干旱、洪涝、极端温度、光照强度以及土壤盐碱度。这些胁迫不仅影响植物的生长发育,还对其生存构成威胁。为了适应并克服这些逆境,植物进化出了复杂的防御机制和生理适应策略,竭力在逆境中求生。
|
分类 |
胁迫类型 |
主要影响 |
植物响应机制 |
|
生物胁迫 |
病原体 |
引发疾病,消耗植物营养 |
产生抗病蛋白,激活系统获得性抗性 |
|
害虫 |
损伤植物组织,传播病原体 |
合成次生代谢物(如生物碱),诱导防御反应 |
|
|
杂草 |
竞争光照、水分、养分,可能作为病原体或害虫的宿主 |
发展更深的根系,增加生物量 |
|
|
动物侵扰 |
物理损伤,减少生长 |
增强物理防御结构,如刺、硬壳 |
|
|
非生物胁迫 |
干旱 |
减少水分供应,影响光合作用和生长 |
调整根系结构,关闭气孔减少水分蒸发 |
|
洪涝 |
根部缺氧,影响根系功能 |
发展透气组织,增加根部呼吸能力 |
|
|
温度过高/过低 |
影响酶活性,破坏细胞膜结构 |
调节代谢途径,合成热休克蛋白或冷适应蛋白 |
|
|
光照过强/过弱 |
影响光合作用效率 |
调整叶片角度,合成光保护色素,改变叶绿体分布或结构以提高光合作用效率 |
|
|
土壤盐分过高 |
影响水分和养分吸收 |
积累渗透调节物质,如脯氨酸、甜菜碱,有助于维持细胞内的水分平衡和渗透压 |
深入研究植物胁迫下的分子互作机制是理解其适应性的关键,也是农业技术创新与作物改良的基石。运用酵母双杂交(Y2H)、双荧光素酶报告系统(DLR)、双分子荧光互补(BiFC)、荧光素酶互补实验(LCA)、ChIP-qPCR以及植物亚细胞定位等技术方法,研究人员能够揭示植物体内基因、蛋白及信号传导的精细调控网络,有望培育出更加坚韧、高产的作物,推动农业向着可持续的未来迈进。下面我们来看两个具体案例,深入探寻植物在生物与非生物胁迫下的生存之道和内在机制。
案例一:非生物胁迫 NF-Y转录因子调控大豆耐旱和盐胁迫响应的分子机制
随着气候变化的到来,干旱、盐、热、冷等非生物胁迫对植物生长的影响日益严重,其中干旱和盐胁迫严重影响大豆的发育,导致产量损失重大。甾醇类化合物在医疗领域发挥着重要作用,具有抗炎、抗氧化以及抗癌等功能,且普遍存在于高等植物中。然而,关于该类化合物在植物中的调控机制以及功能研究报道甚少。2024年3月,中国农业科学院作物科学研究所作学术团队在Plant Biotechnology Journal在线发表了题为“Soybean steroids improve crop abiotic stress tolerance and increase yield”的研究论文,该研究揭示了NF-Y转录因子复合体通过调控大豆甾醇合成途径限速关键酶SQE1基因表达,可增强大豆应对干旱和盐胁迫能力的分子机制,为培育抗逆大豆品种提供了新的理论基础。

文章要点如下:
●GmNF-YC9介导的CCAAT盒转录复合体提高大豆耐逆性
●GmNF-YC9与候选蛋白的相互作用验证
➣通过筛选大豆cDNA库,研究者确定了几个正向克隆,随后通过酵母双杂交(Y2H)、双分子荧光互补(BiFC)、荧光素酶互补成像(LCI)和pull-down分析,证实了GmNF-YC9与GmNF-YA2、GmNF-YC9与GmNF-YB24以及GmNF-YA2与GmNF-YB24之间的相互作用。
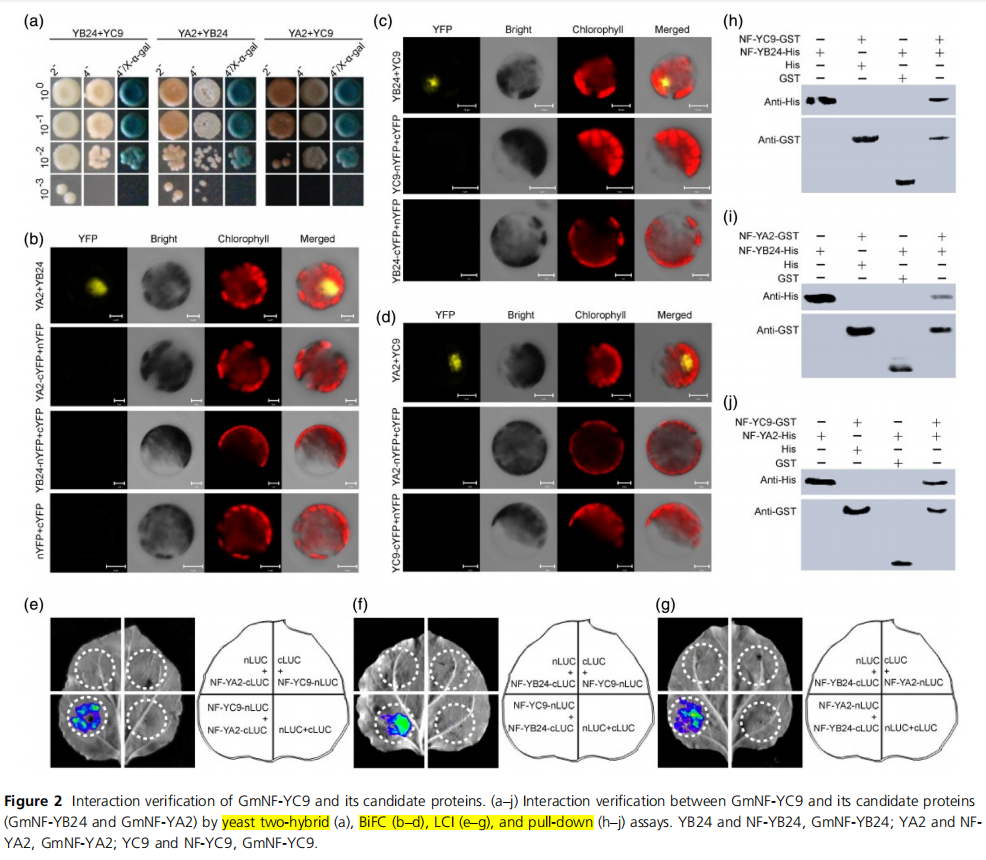
图源:https://onlinelibrary.wiley.com/doi/10.1111/pbi.14349
●GmNF-YC9介导的CCAAT盒转录复合体激活GmSQE1表达
●过表达GmSQE1提高大豆干旱和盐胁迫耐受性
●GmSQE1和GmNF-YC9提高对氧化胁迫的耐受性
案例二:生物胁迫 SlWRKY45参与茉莉素途径调控番茄对南方根结线虫抗性的新机制
根结线虫是世界第二大土传病害,植物激素茉莉素(JAs)调控番茄对根结线虫的抗性,然而其作用机制尚不清楚。2022年,Horticulture Research在线发表了北京农学院学术团队题为“SlWRKY45 interacts with jasmonate-ZIM domain proteins to negatively regulate defense against the root-knot nematodeMeloidogyne incognitain tomato”的研究论文,该论文揭示了转录因子SlWRKY45参加茉莉素合成和信号转导途径负调控番茄对南方根结线虫的抗性。

文章要点如下:
●揭示SlWRKY45与SlJAZs相互作用
➣通过酵母双杂交系统发现SlWRKY45与大多数SlJAZ成员相互作用
➣LCA和BiFC分析证实SlJAZ与SlWRKY45的核内互作
➣SlWRKY45定位于细胞核
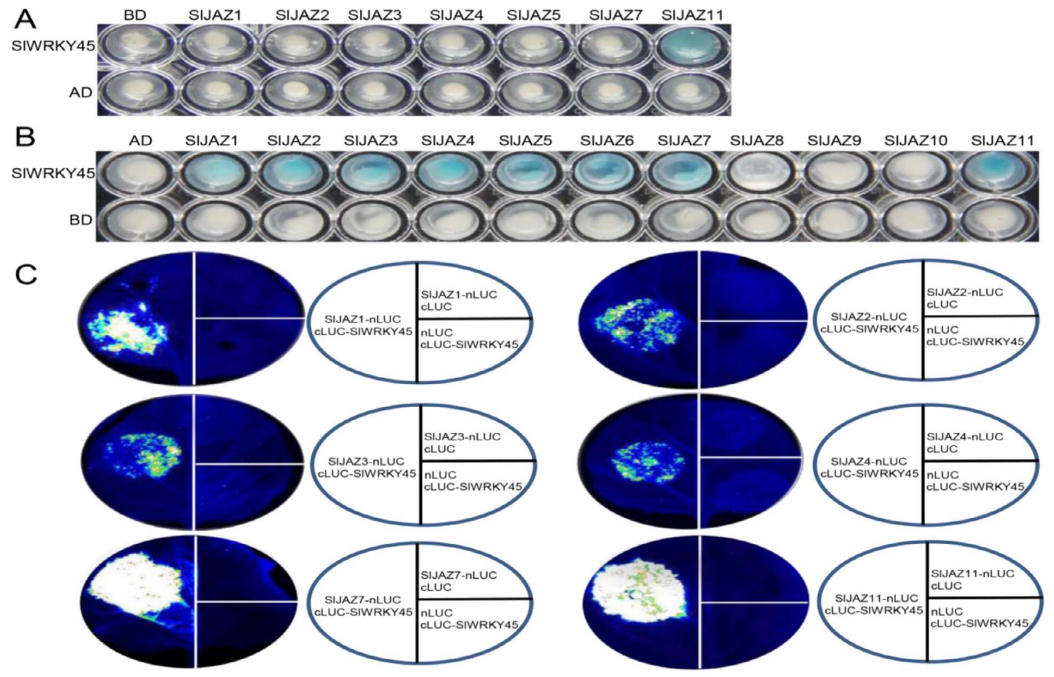
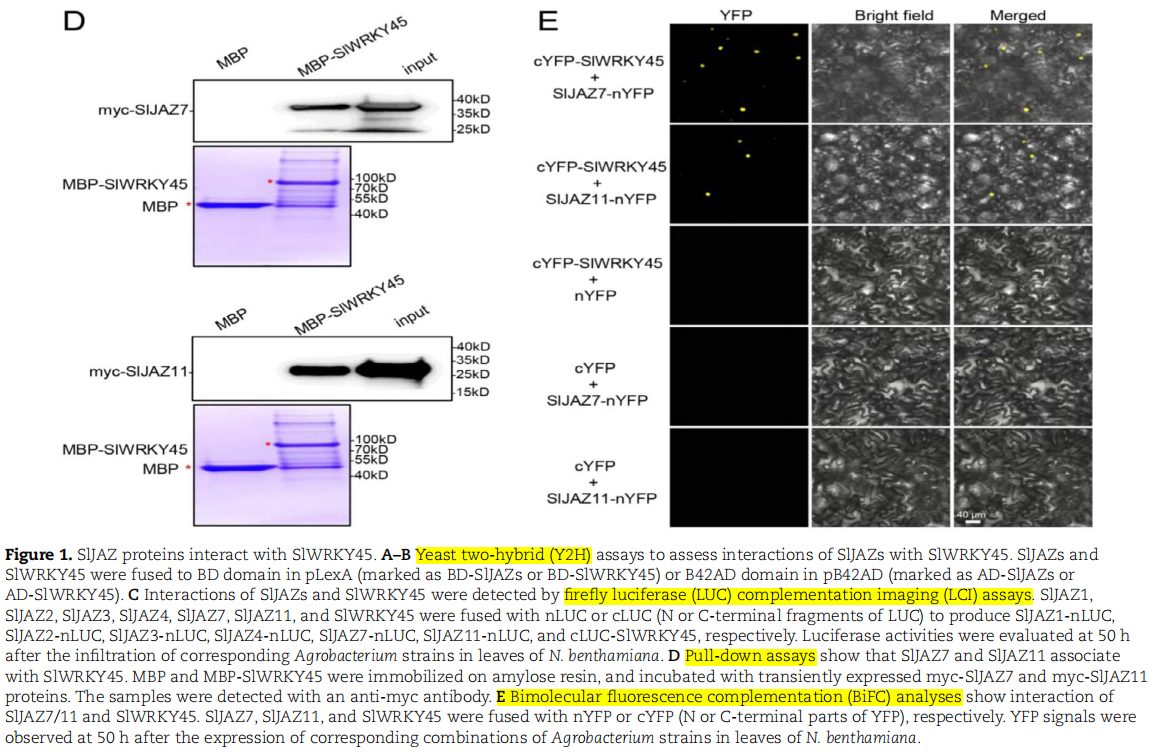
图源:https://doi.org/10.1093/hr/uhac197
●SlWRKY45功能缺失增强番茄对根结线虫的抗性
●SlWRKY45过表达降低番茄对根结线虫的抗性
●SlWRKY45结合并抑制JA生物合成基因SlAOC的表达
➣通过ChIP-qPCR分析证实,SlWRKY45直接结合到SlAOC基因的启动子区域,并通过双荧光素酶报告基因检测证实SlWRKY45抑制了SlAOC的表达。
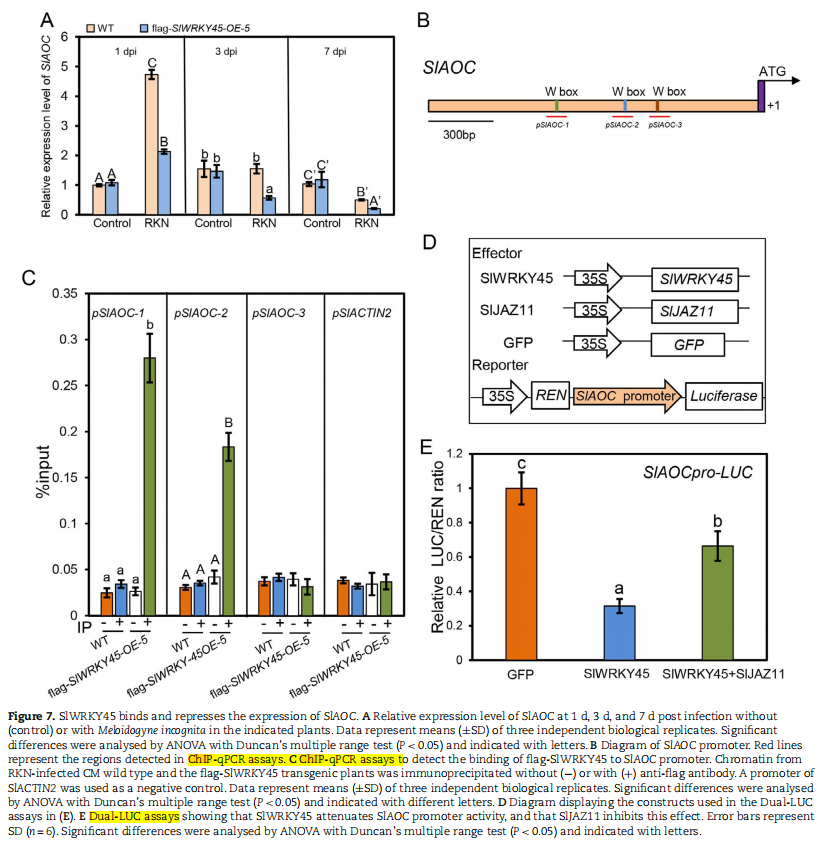
图源:https://doi.org/10.1093/hr/uhac197
总的来说,植物抗逆研究作为现代农业科学的核心领域,不仅致力于揭示植物如何在逆境中顽强生存与繁衍,更旨在将这些珍贵的知识转化为实际应用,以提升作物的适应性与产量,保障全球食品安全。这一领域的研究方法日新月异,结合了分子生物学、遗传学、生理学与生态学等多个学科的先进工具,借助了诸如双荧光素酶实验(DLR)、双分子荧光互补(BiFC)、荧光素酶互补实验(LCA)、ChIP-qPCR以及植物亚细胞定位等研究方法,为作物改良和提高农业生产的可持续性提供了强有力的技术支持,引领着现代农业向着更加精准与高效的未来迈进。
|
技术名称 |
原理简介 |
在植物胁迫研究中的应用 |
|
酵母双杂交(Y2H) |
利用酵母细胞内两个转录激活因子的重组来检测蛋白质间的相互作用。 |
发现植物中参与胁迫响应的蛋白质相互作用,识别关键调控因子。 |
|
双荧光素酶报告系统(DLR) |
使用两种不同波长的荧光素酶来检测转录活动的变化。 |
分析基因表达调控中的顺式作用元件和反式作用因子,了解胁迫响应的转录调控机制。 |
|
双分子荧光互补(BiFC) |
将荧光蛋白分割成两个非荧光部分,并通过蛋白质相互作用恢复荧光。 |
定位活体细胞中蛋白质-蛋白质的相互作用,研究胁迫响应中的分子网络。 |
|
荧光素酶互补实验(LCA) |
类似于BiFC,但使用荧光素酶而非荧光蛋白。 |
检测蛋白质间的直接相互作用,尤其是在植物细胞内,揭示胁迫响应的分子机制。 |
|
使用荧光蛋白标记蛋白质,观察其在细胞内的分布情况。 |
确定特定蛋白质在细胞器中的位置及其功能,理解胁迫响应中的亚细胞定位变化。 |
|
|
结合染色质免疫沉淀技术和实时定量PCR,研究DNA-蛋白质结合。 |
鉴定转录因子在特定基因启动子区域的结合位点,了解胁迫响应的转录调控。 |
武汉金开瑞生物工程有限公司是一家专业致力于为全球制药企业、诊断试剂企业、科研试剂研发企业、高校和科研院所以及大型医院提供蛋白及相关研究技术服务的高新技术企业。金开瑞不仅能够提供包括以上六种经典技术在内的10余项分子互作检测服务,还承接包括基因克隆、载体构建、蛋白质表达与纯化、抗体定制、机制研究等一站式技术服务。期待与您携手同行,共同推动农业科技的发展,为农作物的高产、优质和可持续性发展贡献力量。
最新动态
-
04.22
Biology:藏红花花被片中外泌体样纳米颗粒的表征及其免疫刺激活性
-
04.22
酵母建库技术全解析:从原理到实战,助你轻松构建高质量文库
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!










