收藏!一文全方位了解双分子荧光互补(BiFC)技术
蛋白质是生命体的重要组成部分,是生命活动的主要承担者和执行者。据估计,超过80%的蛋白质并不是孤立存在,而是与其他蛋白质通过相互作用形成稳定或瞬时的复合物结构。蛋白质-蛋白质相互作用(protein-protein interactions,PPIs)是分子生物学中最重要的现象之一,几乎在所有的生命过程如信号转导、细胞通讯、代谢、转运、免疫应答和基因转录中都起着关键作用。因此,研究蛋白质-蛋白质相互作用对于阐明蛋白质分子的生物功能以及分子作用机理具有重要的意义。

鉴于蛋白质-蛋白质相互作用(PPIs)在生命活动中的核心地位,深入探索其细节与动态过程已成为科研人员的不懈追求。在众多研究方法中,双分子荧光互补(Bimolecular Fluorescence Complementation, BiFC)技术作为一种直观且强大的工具,近年来在PPIs研究中崭露头角。其原理是将荧光蛋白切开分为N-和C-两个片段,分别与待验证的两个蛋白A和B融合表达,如果蛋白A和B能够接近发生互作,那么荧光蛋白片段N-和C-也会跟着一起靠近并重新构成完整的有活性的蛋白,从而发出荧光。

图1. BIFC发光原理图
金开瑞使用的是YFP荧光蛋白的变体Venus,其荧光强且背景敏感度低,将其分为了N端173个氨基酸和C端155个氨基酸,两个载体以VN173和VC155表示。两个待测蛋白分别连接到VN173和VC155载体上,在转化农杆菌并注射烟草后进行检测。操作步骤如下所述:
(1) 基因合成及载体构建
A基因模板构建到VC155-21OV303_pC2300-mVYCE载体上测序验证(带有HA标签);
B基因模板构建到VN173-21OV302_pC1300-mVYNE载体中测序验证(带有myc标签)。
(2) 质粒转化及烟草注射
♦ 种植本氏烟草(Nicotiana benthamiana):将萌发的本氏烟草(Nicotiana benthamiana)在16 h光照/8 h黑暗,温度28℃,相对湿度70%条件下培养大概4~5周;
♦ 对合成好的载体进行农杆菌转化GV3101(pSoup-p19);
♦ 挑取含有目的载体的农杆菌单克隆,在含有10 mL相应抗生素(K+Rif+)的LB液体培养基中扩大培养,大概培养36h~48h。
♦ 室温,7000 rpm离心2 min收集菌体,用MES缓冲液(10mL)清洗菌液一次,加入5 mL的MES缓冲液,取稀释十倍的菌液测量OD600的值,调整OD600为1.2~1.6(1.4)左右,等体积混合两种菌液,加入乙酰丁香酮至终浓度为150 μM。摇菌1~1.5h;
计算公式:
♦ 混合菌:1.4*摇菌体积=OD值*菌体积*10
♦ 单菌:0.7*摇菌体积=OD值*菌体积*10
♦ 选取生长期为1个月左右完全伸展的烟草叶片,将混合好的菌液用1 mL注射器(去掉针头)从烟草叶背面进行注射。
♦ 室温避光培养36~48h后在激光共聚焦下拍照
♦ 菌液组合如下表:

(3) 实验交付
1、返还目的基因剩余质粒;
2、默认做1个阳性对照,3个阴性对照,1个实验组,共5组;
3、1组阳性对照和3组阴性对照各交付1个视野,实验组交付4-5个视野,每个视野都包含YFP、Bright field、Merge 3张图;
4、结题报告以及全部原始数据。
(4)结果解读
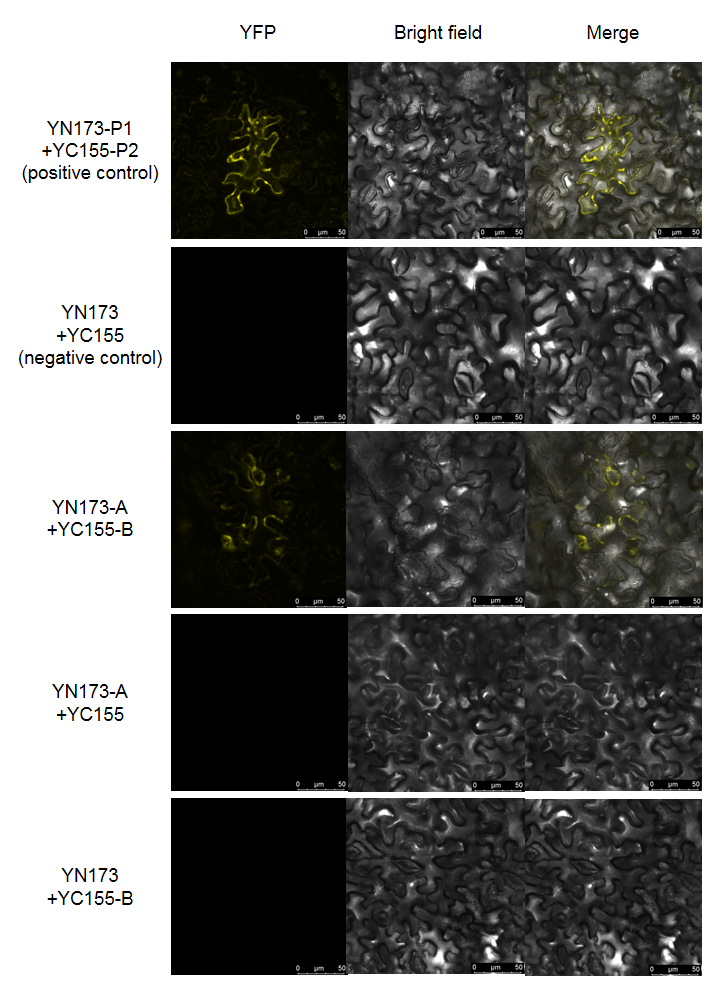
1、默认分组方式如左图所示,每组每个视野都会拍摄荧光、明场以及融合3张照片;
2、“YN173-P1 + YC155-P2”为阳性对照,“P1”和“P2”是已知能够互作的蛋白,我司使用SPX4蛋白作为阳性对照,该蛋白能够与自身形成二聚体(引自:DOI: 10.1105/tpc.114.123208);
3、“YN173 + YC155”为阴性对照,转染的一对空载质粒,不会检测到荧光;
4、“YN173-A + YC155-B”为实验组,“A”和“B”指代待验证是否互作的一对蛋白,在阴阳性对照正常的情况下,如果实验组能检测到荧光,说明两个蛋白能够互作,反之说明两个蛋白不能互作;
5、“YN173-A + YC155”和“YN173 + YC155-B”为单分子对照组,同阴性对照不会检测到荧光;
6、由于融合表达蛋白空间构象的问题,有时在没有检测到互作的情况下,调换两个蛋白的BiFC载体重新验证,又能够检测到互作。
(5)注意事项
1、荧光蛋白片段的选择与验证:确保所选荧光蛋白片段(如GFP的N端和C端)在单独表达时不产生荧光,避免假阳性;
2、融合蛋白的表达:验证融合蛋白(目标蛋白与荧光蛋白片段的融合)在细胞中的正确表达和定位;
3、转染效率优化:调整转染条件以提高目标细胞内的融合蛋白表达水平,同时减少细胞毒性;
4、时间控制:精确控制荧光蛋白表达的时间窗口,确保在细胞生理状态下观察PPIs;
5、荧光观察与成像:使用合适的显微镜和成像设置,清晰捕捉荧光信号,区分真实信号与背景噪声;
6、对照实验:设立明确的阴性和阳性对照,以区分非特异性结合和真实PPIs;
7、实验条件一致性:保持每次实验条件(如细胞类型、培养条件、成像参数等)的一致性,以便于结果比较。
(6)常见问题与解答
1、如何确保BiFC实验中检测到的荧光信号反映的是真实的蛋白质相互作用?
为了确保荧光信号的真实性,需要排除假阳性的可能性。假阳性可能是由于荧光蛋白片段的非特异性相互作用或其他非目标蛋白质之间的相互作用引起的。因此,在实验中应设置对照组,如单独表达荧光蛋白片段或目标蛋白的对照组,以排除非特异性相互作用的干扰。此外,还可以结合其他实验方法,如免疫共沉淀(Co-IP)、共定位、酵母杂交等,来进一步验证蛋白质相互作用。
2、BiFC实验中检测到的荧光信号较弱,如何优化?
荧光信号较弱可能是由于荧光蛋白片段与目标蛋白的融合效率不高,或者融合蛋白在细胞内的表达量较低。为了优化荧光信号,可以尝试增强启动子,以提高融合蛋白的表达水平。此外,还可以优化转染条件,确保细胞具有较高的转染效率。在制片过程中,应尽可能清理干净叶片表面的杂质,排除气泡,以减少背景干扰。
3、BiFC实验中没有检测到荧光信号,可能的原因是什么?
可能的原因有多种。首先,可能是所研究的蛋白质之间确实不存在相互作用,因此无法形成完整的荧光蛋白。其次,可能是荧光蛋白片段与目标蛋白的融合构建存在问题,导致融合蛋白不能正确表达或折叠。此外,实验条件、细胞状态或转染效率等因素也可能影响荧光信号的检测。针对这种情况,建议重复实验,优化实验条件,并检查融合蛋白的表达情况。
(7)写作参考

图源: https://doi.org/10.3390/ijms241914870
在介绍了BiFC技术的基本原理、实验操作、注意事项等理论知识之后,接下来小金将通过具体的文献案例来探讨这一技术在不同物种实际研究中的应用,以期为广大读者朋友们提供些许有益的启示和借鉴。
案例一:动物
神经氨酸酶1促进雄性小鼠肾纤维化进展

研究人员通过临床肾纤维化患者组织样本、2种肾纤维化动物模型及细胞模型,发现NEU1在肾纤维化中过度活化。作者构建了肾小管上皮细胞特异性NEU1敲除和过表达小鼠,通过PCR array、Co-IP、BiFC、SPR等实验技术发现,NEU1选择性结合ALK5的160-200氨基酸区域,从而稳定ALK5,促使ALK5-Smad2/3信号通路持续激活,最终诱发肾纤维化。
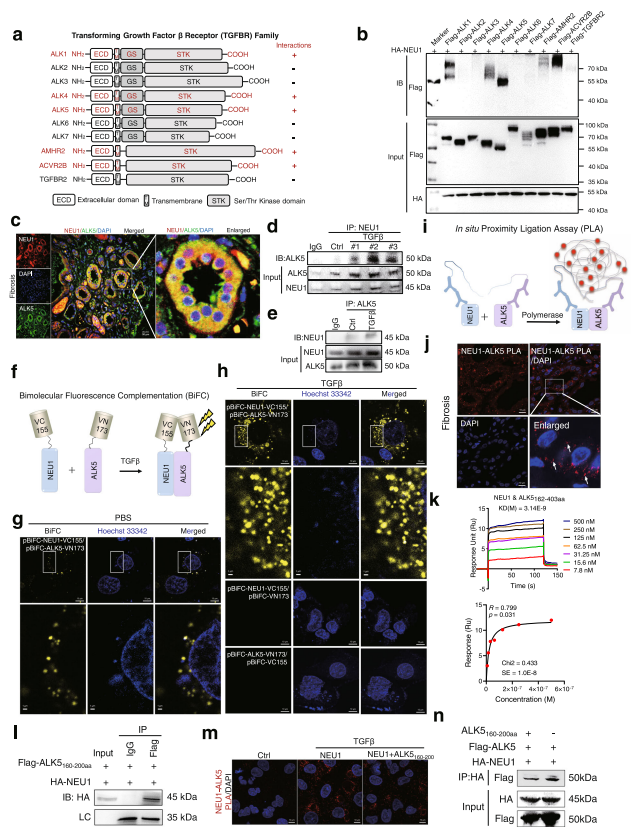

图源:https://doi.org/10.1038/s41467-023-37450-8
案例二:植物
VvDELLA2和VvCEB1相互作用介导GA诱导的葡萄果实膨大相关基因表达

在这项研究中,作者报道了外源性GA3介导VvDELLA2对VvCEB1的抑制作用,以调节葡萄果实早期膨大。酵母双杂交(Y2H)和双分子荧光互补(BiFC)表明VvDELLA2通过与VvCEB1的活化结构域结合而与VvCEB1相互作用。电泳迁移率位移试验(EMSA)和荧光素酶报告基因实验显示,VvCEB1与VvEXPA8和VvEXPA11的启动子相互作用,激活LUC报告基因的表达。
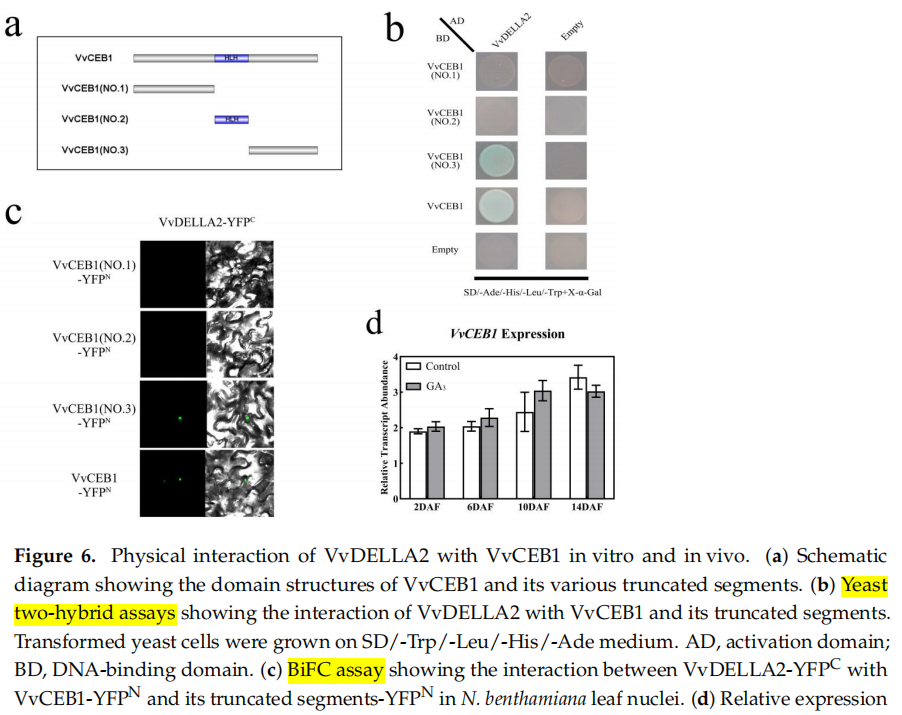
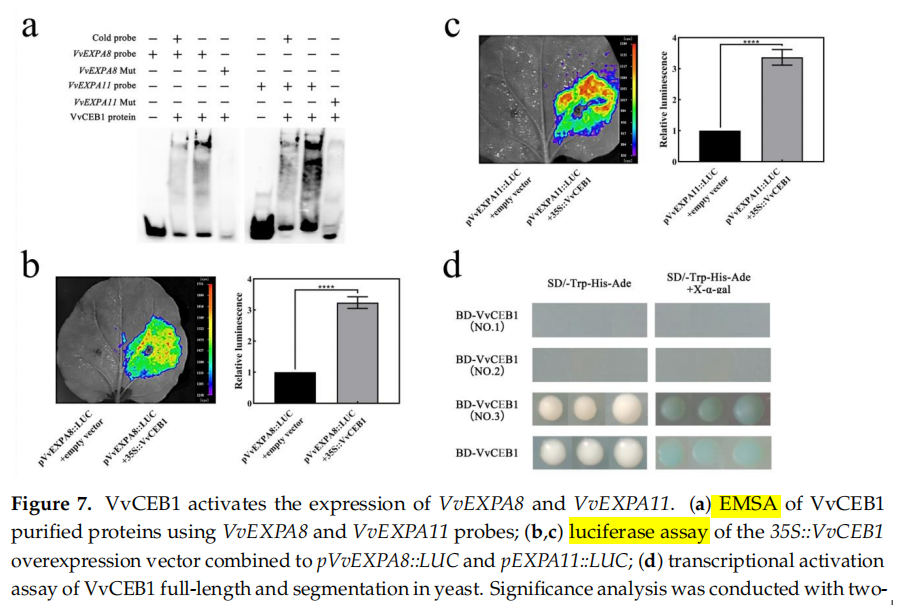
图源:https://doi.org/10.3390/ijms241914870
案例三:细菌
麦芽糖梭菌或可用作益生菌来预防女性肠道肿瘤

为了探索麦芽糖梭菌的雌激素介导的附着表型是否仅依赖于SLC3A2,研究者敲除了正常结肠上皮细胞中的SLC3A2,发现17β-雌二醇不能增加麦芽糖梭菌在正常结肠上皮细胞的附着。通过BiFC、ELISA等进一步确认了DD-CPase(麦芽糖梭菌表面的SLC3A2结合蛋白)和SLC3A2之间的直接相互作用。总体而言,这些发现表明雌激素可以通过细菌表面蛋白DD-CPase促进麦芽糖梭菌的粘膜附着和定植,从而增强结肠SLC3A2表达。
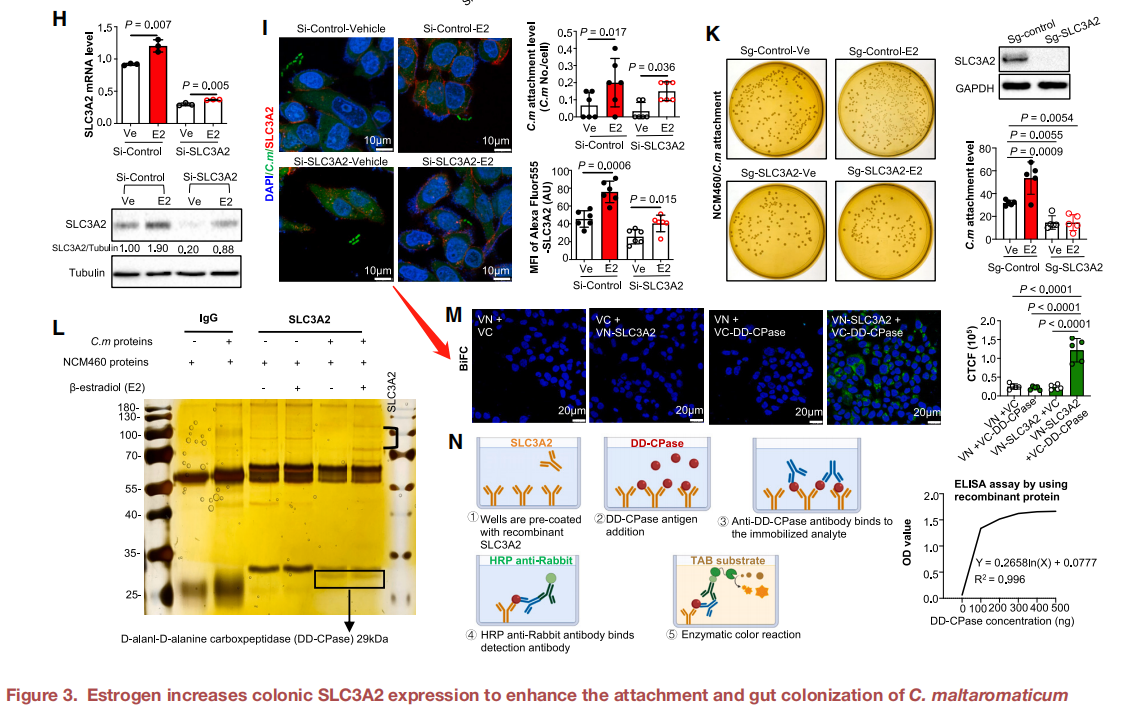
图源:https://doi.org/10.1016/j.ccell.2023.06.011
案例四:病毒
potyvirridae植物病毒中的6-kilodalton peptide 1是一种病毒蛋白

为了探究6K1的生物学功能,作者分析了芜菁花叶病毒(TuMV) P3、6K1和P3-6K1在烟叶表皮细胞中的亚细胞定位。由于YFP-6K1在benthamiana叶片的表皮细胞中形成颗粒,PPVencoded的6K1在病毒感染期间形成点状内含物,作者怀疑6K1寡聚成多聚体。因此随后进行了双分子荧光互补(BiFC)和免疫共沉淀(Co-IP)实验来解决这个问题,结果证实了6K1的自相互作用能力。

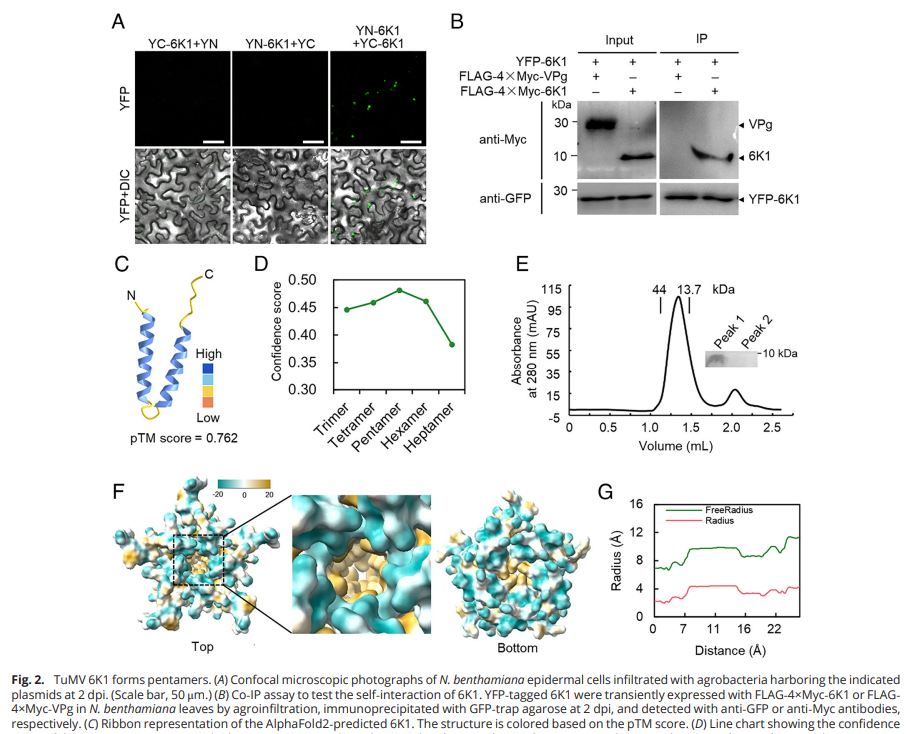
图源:https://doi.org/10.1073/pnas.2401748121
在深入探讨了BIFC技术在动物、植物、细菌和病毒等多种生物体系中的应用实例后,我们不难发现这一技术在揭示蛋白质-蛋白质相互作用(PPIs)方面展现出了独特的魅力。然而,任何技术都不可能完美无瑕,BIFC技术也不例外。
|
优点 |
不足 |
|
>直观性:直接在活细胞中观察PPIs,保留天然环境。 |
>温度敏感性:对系统温度敏感,可能影响PPIs的真实反映。 |
|
>高灵敏度:低浓度下检测PPIs,便于定量分析。 |
>信号滞后性:荧光信号可能滞后于实际PPIs过程。 |
|
>广泛适用性:适用于多种生物体系,拓宽研究范围。 |
>假阳性信号:荧光蛋白片段可能随机碰撞产生假阳性。 |
|
>易于操作:实验步骤简单,数据处理直观。 |
>表达效率差异:不同基因表达效率不一,影响荧光信号强度。 |
|
>背景干净:低背景信号,有利于准确观察。 |
>技术局限性:无法直接揭示PPIs的具体机制或结构信息。 |
因此,为了确保蛋白质-蛋白质相互作用(PPIs)研究结果的准确性和可靠性,研究人员通常会综合运用多种验证方法,如免疫共沉淀(Co-IP)、酵母双杂交(Y2H)、GST pull-down和荧光素酶蛋白互补实验(LCA)等,以多角度、多层次地验证PPIs的真实存在。比如下面这篇文献(https://doi.org/10.1093/plphys/kiad057),作者就运用了四种实验方法证实MdMYB8与MdERF114之间存在相互作用。

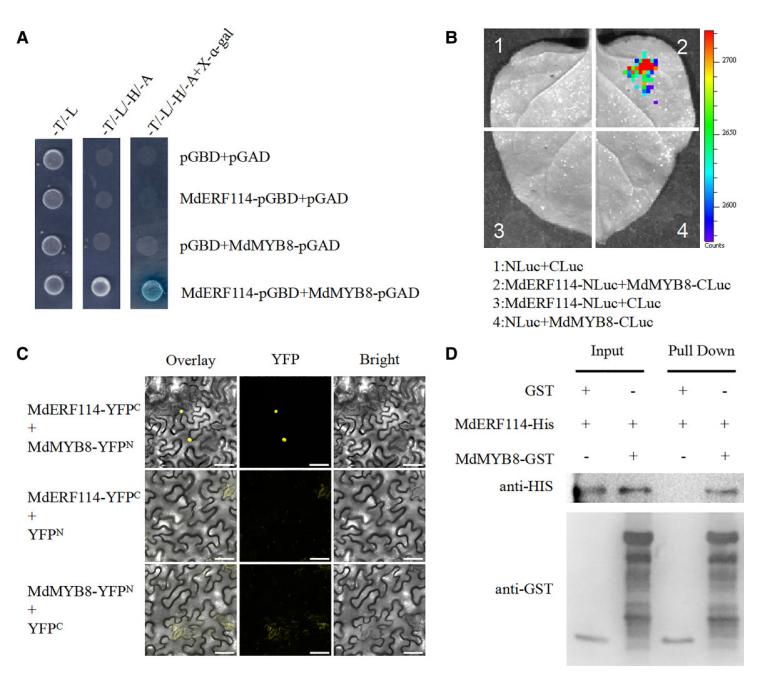
A:酵母双杂交(Y2H)实验表明,在酵母中,MdMYB8能够与MdERF114相互作用。
B:通过荧光素酶互补实验发现,只有当MdERF114-Nluc和MdMYB8-Cluc共同注射时,才会观察到荧光信号,证明二者相互作用。
C:双分子荧光互补(BiFC)实验中,观察到MdMYB8与MdERF114在细胞核内发生相互作用。
D:Pull-down实验结果显示,MdERF114-HIS能够被MdMYB8-GST捕获,但不能被谷胱甘肽S-转移酶(GST)单独捕获,进一步证实了两者的直接相互作用。
正如蛋白质之间相互协作可以发挥更大的作用一样,选择一家可靠的服务公司对于科研工作同样至关重要。武汉金开瑞生物工程有限公司作为国内外知名的高新技术企业,专精于为全球范围内的制药行业、诊断与科研试剂开发商、高等学府、科研机构,乃至大型医疗机构提供核酸与蛋白研究相关的一站式技术服务及试剂盒产品。金开瑞分子互作(蛋白-蛋白、蛋白-核酸、核酸-核酸)研究平台,汇聚了双荧光素酶报告基因、双分子荧光互补(BIFC)、免疫共沉淀(Co-IP)、酵母杂交(YIH/Y2H)、GST pull-down、ChIP、RIP、EMSA和荧光素酶蛋白互补实验(LCA)等十余种前沿互作技术,无论是在医学研究、新药开发,还是农业科学、作物改良等领域,均能提供个性化研究方案,助力加速项目进程。期待与您并肩同行,共同揭开生命科学与应用技术的崭新篇章~

最新动态
-
06.27
Foods | 黑果枸杞类外泌体提取工艺优化及其对HT22细胞中AB诱导的细胞凋亡和氧化应激的抑制作用
-
06.23
科研小白必看的Co-IP结果解读
-
06.19
史上最全的ATAC-seq实验技术详解
-
06.19
INT J NANOMED | 源自鹿茸间充质干细胞的外泌体可以促进伤口愈合
-
06.19
Nutrients |葱衍生的外泌体样纳米颗粒可防止谷氨酸触发的铁性细胞死亡
-
06.09
表观遗传学”新宠“ - CUT&Tag技术
-
06.09
蛋白互作研究利器:Co-IP实验的核心要点
-
06.09
Int J Nanomedicine|连翘来源外泌体:一种用于有效肿瘤光动力治疗的新型天然光敏剂
-
06.09
Food Science & Nutrition |石榴来源的外泌体样纳米囊泡在脂肪性肝病中的治疗潜力
-
05.21
【避坑指南】EMSA实验全攻略 梯度探针设计










