酵母双杂交点对点验证怎么做?及常见问题回答
蛋白质是生命的物质基础,在生命活动中扮演着至关重要的角色。蛋白质控制着细胞内的所有生物体系,虽然很多蛋白质可以各自独立地执行自身的功能,但绝大多数蛋白质需要与其他蛋白质相互作用才能保有完整的生物活性。为了研究蛋白质的功能,酵母双杂技术应运而生,成为了研究学者研究蛋白质间相互作用的科研神器。
一.实验原理
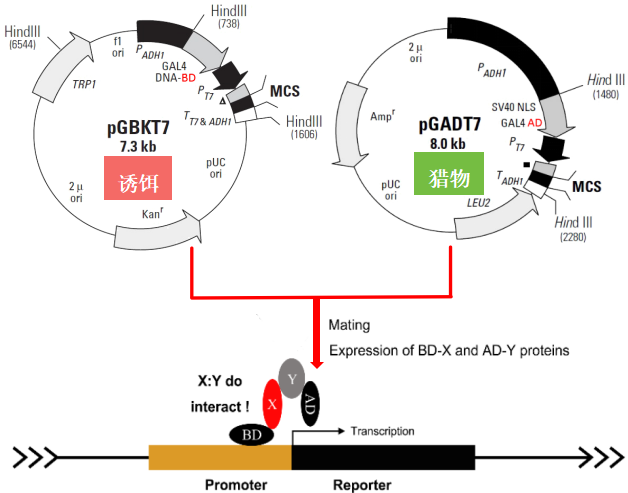
酵母核体系双杂交技术是基于对真核细胞转录因子特别是酵母转录因子GAL4性质的研究,GAL4包括两个结构域,即DNA结合结构域(DNA-binding domain,BD)和转录激活结构域(Activating domain,AD)。BD能够识别位于GAL4效应基因(GAL4-responsive gene)的上游激活序列(Upstream activating sequence,UAS)并与之结合,AD可以启动UAS下游的基因进行转录。BD和AD分别单独作用并不能激活转录,但是当二者在空间上充分接近时,则呈现完整的GAL4转录因子活性并可激活UAS下游启动子,转录启动子下游基因并使其表达。
检测蛋白-蛋白相互作用:
♦诱饵蛋白(Bait Protein):将待测的第一个蛋白质(X)与BD融合,形成BD-X融合蛋白。
♦猎物蛋白(Prey Protein):将待测的第二个蛋白质(Y)与AD融合,形成AD-Y融合蛋白。
如果X和Y蛋白质在细胞内相互作用,它们各自携带的BD和AD就会靠近,重新形成功能完整的转录激活因子,从而激活报告基因的表达。通过检测报告基因的表达(例如生长在缺陷营养培养基上,产生颜色反应等),可以判断X和Y是否相互作用。
二、实验步骤和流程
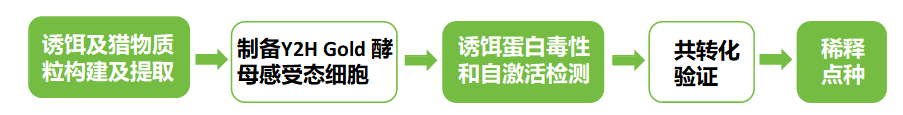
质粒抽提:将构建好的诱饵及猎物质粒转化至大肠杆菌中,经过涂板及培养后,收集菌体,进行质粒抽提;
准备Y2HGold酵母感受态细胞:将酵母Y2H Gold划线于YPDA固体培养基,经过培养后获得重悬菌体,分装后置于冰上备用;
诱饵重组质粒自激活和毒性检测:配转化体系进行检测,根据菌落生长状况确定合适的3-AT浓度,后续共转验证可⽤该浓度的3-AT;
共转化:将含有BD结构域的诱饵质粒(如pGBKT7)和含有AD结构域的猎物质粒(如pGADT7)共转化入酵母菌株(如Y2H Gold);
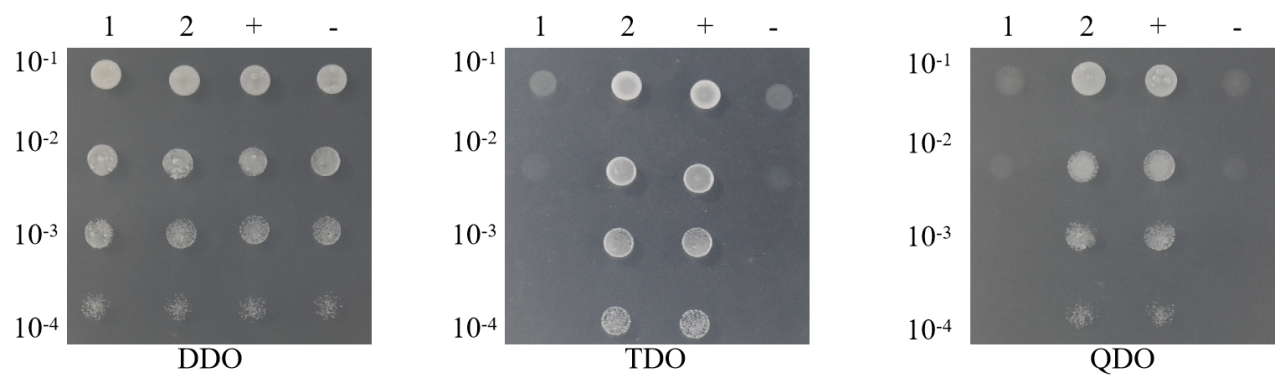
稀释点种:将转化后的菌液涂布于营养缺陷型平板上(如DDO、TDO、QDO等),进行筛选。这些平板中缺乏特定的氨基酸或核苷酸,只有成功表达的报告基因能够互补这些缺陷,从而使酵母细胞生长;
培养与观察:将平板置于恒温箱中培养,并观察酵母细胞的生长情况;
数据整理:拍照记录实验结果,并进行整理和分析;
三、点对点验证实验结果怎么看?
稀释点种验证结果
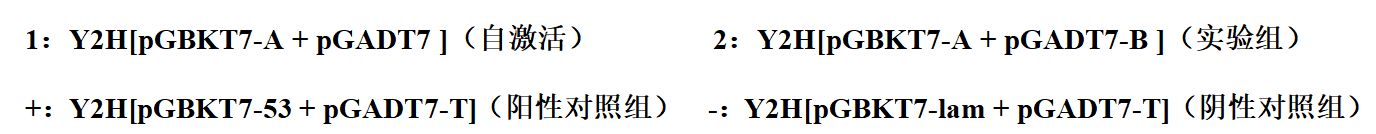
1)阳性对照组Y2H[pGBKT7-53 + pGADT7-T]在DDO、TDO/ 3-AT X mM(3-AT的浓度通过自激活验证获得)、QDO上均有菌落生长,阴性对照组Y2H[pGBKT7-lam + pGADT7-T]在DDO有菌落生长,在TDO/ 3-AT X mM(3-AT的浓度通过自激活验证获得)、QDO上无菌落生长,则说明整套实验操作系统没有问题;
2)自激活组Y2H[pGBKT7-A + pGADT7]在DDO有菌落生长,在TDO/ 3-AT X mM(3-AT的浓度通过自激活验证获得)、QDO上无菌落生长,则说明重组诱饵质粒成功转入宿主菌且对宿主无毒性;且在特定的3-AT浓度下,诱饵质粒不能激活酵母细胞报告基因的表达,可以进行下一步共转实验;若自激活组在TDO/ 3-AT 15 mM平板上有菌落生长,则说明诱饵蛋白有很强的自激活,需要将诱饵蛋白截短后再进一步进行自激活验证,确保无自激活才可进行互作验证;
3)实验组Y2H[pGBKT7-A + pGADT7-B]在DDO有菌落生长,说明诱饵A和猎物B共转化成功,在TDO/ 3-AT X mM(3-AT的浓度通过自激活验证获得)、QDO上有菌落生长,说明诱饵A和猎物B有互作,在TDO/ 3-AT X mM(3-AT的浓度通过自激活验证获得)上有菌落生长、QDO上无菌落生长,说明诱饵A和猎物B有弱互作;在TDO/ 3-AT X mM(3-AT的浓度通过自激活验证获得)、QDO上均无菌落生长,说明诱饵A和猎物B无互作。若实验组Y2H[pGBKT7-A + pGADT7-B]在DDO无菌落生长,则说明转化失败,需要重新进行转化。
四、为什么选择试剂盒来研究蛋白互作?

自己动手,丰衣足食,购买试剂盒自己进行实验操作更具性价比,既可以降低实验成本,又能提升实验技能和经验,除此之外,我们的试剂盒还进行了各种优化:
1.采用多个筛选步骤,可以减少假阴性结果,以及非特异性相互作用的假阳性结果。
2.每个环节均有严格的质控,实验效率更高。
3.可处理复杂样本,同时筛选和鉴定多个蛋白质间的相互作用,实现高通量的筛选和分析。
4.将报告基因整合到染色体上,使基因表达水平稳定,消除了由于质粒拷贝数变化引起的基因表达水平波动而造成的假阳性结果。
5.性价比高:试剂配套齐全,价格优惠,低于市面上同款产品。
综上所述,酵母双杂交点对点验证是一种可靠且高效的蛋白质相互作用鉴定技术。按照试剂盒说明书的方法,通过严格的实验步骤和对照设置,可以准确地判断蛋白质之间是否存在相互作用,为后续的生物学研究、药物研发以及疾病治疗提供有力支持
五、常见问题及回答
Q1.酵母杂交发生假阳性的原因及解决方式?
产生原因:
(1)由于BD融合诱饵蛋白有单独激活作用,或者其激活作用被外来蛋白激活。
(2)AD融合靶蛋白如果有DNA的特异性结合,也可以单独激活报告基因的表
(3)BD和AD在文库中会有随机碰撞导致空间上的接近,以致下游报告基因的表达。
解决方法:
(1)对于点对点验证来说,可同时将诱饵和猎物进行自激活验证,减少假阳性的判定,但是一旦诱饵和猎物均产生自激活,后续自激活的处理方式(截短)会浪费较多的时间;
(2)由于每个报告基因上游的调控区各不相同,因此用不同的报告基因验证阳性,可用于排除或减少假阳性,这也是我们主要采取的方式;
(3)单杂启动子,我们主要采用将报告基因整合到酵母的染色体上,可以使基因表达水平稳定,消除了由于质粒拷贝数变化引起的基因表达水平的波动而造成的假阳性。
Q2.如果诱饵可以直接激活报告基因,该如何处理?
为保证诱饵蛋白功能的完整性,首先我们会考虑用3’AT/ABA进行背景抑制,但是由于这两种试剂对酵母生长具有较大的毒性,后续可能会影响文库筛选,因此在3’AT超过15mM,ABA超过1200ng/mL时我们会考虑将诱饵蛋白进行截断,通过查阅文献和相关数据库,截去转录激活的区域,但是需要注意的是,截去的这一部分很有可能会影响到互作结果。
Q3.如何从验证结果判断两个蛋白是否互作及互作强度?
酵母核双杂点对点验证是根据是否激活3个报告基因(MELI、HIS、Ade2)来反推是否有互作,是否激活了报告基因又是根据涂布相应平板的颜色反应及菌落有无及大小来判断,因此我们可以直接根据显蓝的强弱、TDO上斑的多少以及大小、QDO上是否能生长来初步判断互作的强弱。
最新动态
-
04.30
Journal of Nanobiotechnology:苦瓜来源的外泌体样稳定p62表达以改善阿霉素心脏毒性
-
04.30
Theranostics-源自水果、蔬菜和草药的类外泌体纳米颗粒:治疗和药物递送的创新策略
-
04.22
Biology:藏红花花被片中外泌体样纳米颗粒的表征及其免疫刺激活性
-
04.22
酵母建库技术全解析:从原理到实战,助你轻松构建高质量文库
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”










