【干货】全方位解析GST Pull-down实验
GST Pull-down实验广泛应用于生物学和医学研究领域,特别是在研究蛋白质相互作用、信号传导途径以及药物靶点筛选等方面。通过该实验,既可以验证两种已知蛋白质之间是否存在直接互作关系(GST Pull-down+WB),也可以用于寻找可能与目标蛋白存在相互作用关系的未知蛋白(GST Pull-down+LC-MS),为深入理解生命活动的分子机制提供重要线索。
一、实验原理
GST Pull-down实验基本原理是利用DNA重组技术将已知蛋白(探针蛋白)与GST(谷胱甘肽巯基转移酶)融合,形成GST融合蛋白。融合蛋白通过GST与谷胱甘肽(GSH)的高亲和力,将GST融合的蛋白质固定在谷胱甘肽包被的琼脂糖珠上,充当一种“诱饵蛋白”。
当含有与诱饵蛋白有相互作用的靶标蛋白(目的蛋白)的溶液过柱时,靶标蛋白会被捕获并与诱饵蛋白结合形成复合物,将复合物洗脱后,通过Western blot分析可以证实两种蛋白的相互作用,或者筛选相应的目的蛋白。
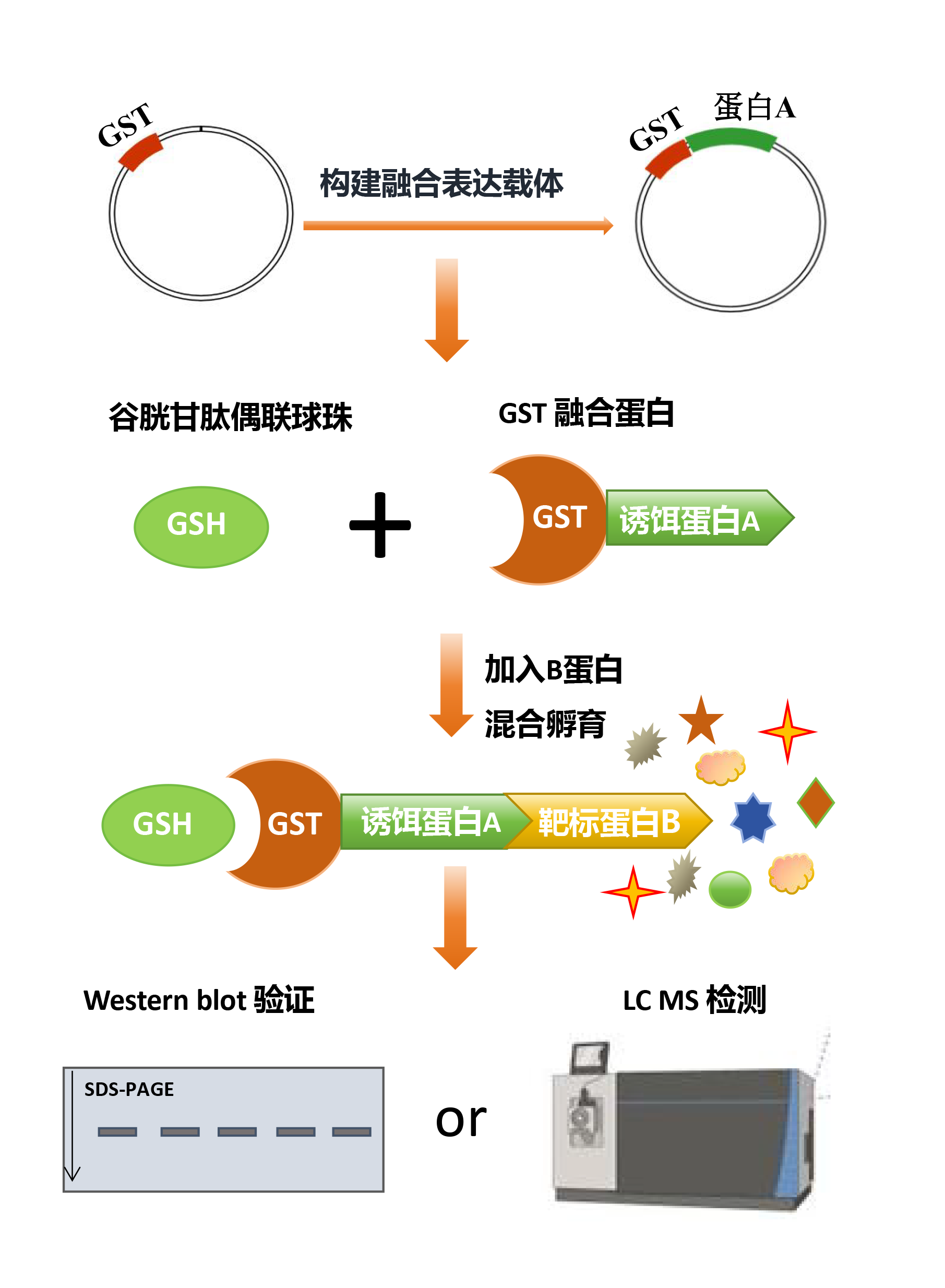
图1. GST Pull -down实验原理图
二、实验流程
1、前期准备:用预冷的1mL PBS洗涤样品(约2 X 10^7个细胞)提取蛋白,并使用WB检测纯化蛋白。
2、获得磁珠结合诱饵蛋白GST-X
3、诱饵蛋白结合互作蛋白Y(亦可带除GST之外的其他标签)或总蛋白
4、与融合蛋白发生相互作用的蛋白被亲和到谷胱甘肽层析柱上
5、洗脱获得相互作用的蛋白
6、pull-down后WB验证上样电泳:各取30ul对照组、实验组、Input对照、Input实验进行聚丙烯酰胺凝胶电泳。

图2. GST Pull -down实验流程图
三、结果解读
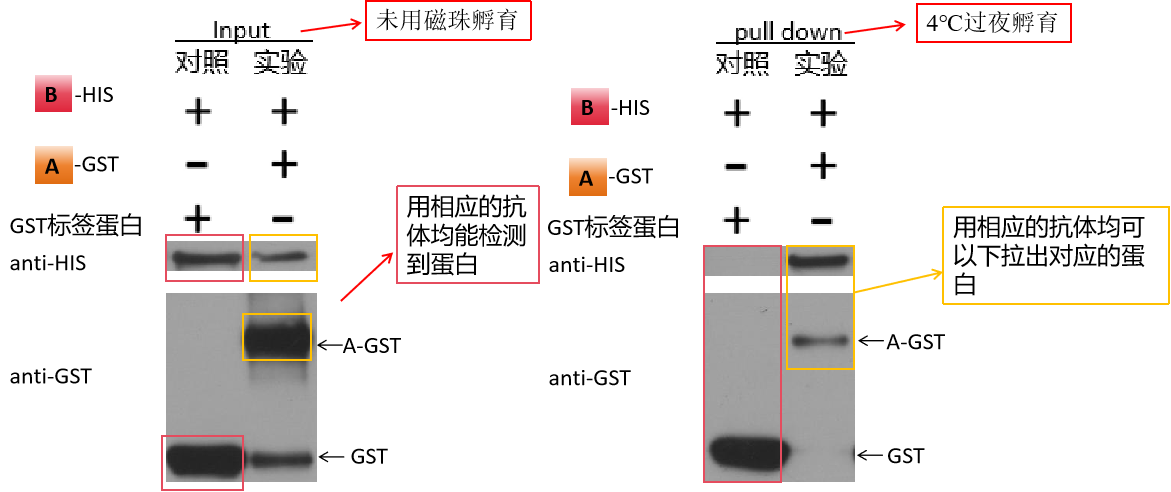
图3. GST Pull -down实验结果图
上图是以A-GST为诱饵、HIS-B为猎物进行的pull-down实验(A和B 代表待验证的诱饵和猎物蛋白),包含对照组、实验组以及各自的 Input组,pull down后分别用GST和HIS抗体检测信号;判定实验成功的标准是能够在检测GST信号时,对照泳道检测到 GST标签蛋白,实验泳道检测到A-GST。
input (阳性对照):
对照组:加入B-HIS(猎物蛋白)+GST标签蛋白
实验组:加入B-HIS(猎物蛋白)+A-GST(诱饵蛋白)
目的:用相应的抗体检测发现均能检测到两组中的四个蛋白,证明实验体系没有问题,GST标签不会和HIS 猎物蛋白有相互作用。
pull down :
对照组:加入B-HIS(猎物蛋白)+GST标签蛋白
实验组:加入B-HIS(猎物蛋白)+A-GST(诱饵蛋白)
对照组中:分别使用HIS 抗体和GST抗体进行检测,可以看到使用HIS抗体检测时并未下拉到蛋白,使用GST抗体检测时下拉到GST蛋白,表明B-HIS(猎物蛋白)和GST标签蛋白没有互作。
实验组中:分别使用HIS 抗体和GST抗体进行检测,使用HIS抗体检测时可以下拉到B-HIS 蛋白,使用GST抗体检测时可以下拉到A-GST蛋白,表明B-HIS 蛋白和A-GST蛋白存在互作。
四、实验优缺点
优点:
➢ 可验证蛋白质-蛋白质之间的直接互作;
➢ GST标记可把一些难溶蛋白变成可溶蛋白,使实验变得更易操作;
➢ GSH谷胱甘肽偶联球珠亲和力强,洗脱纯度高。
缺点:
◆ 验证互作是在试管中进行的生化反应,不能够完全反映细胞内蛋白真实互作的状态;
◆ 两个非同一定位的蛋白可能因电荷或是强亲和力的原因造成假阳性,需要使用其他方法再次验证,比如Co-IP实验等;
◆ 融合表达的GST标签,肽链较长,可能会改变原目的蛋白的原有的折叠结构。
五、GST Pull-down实验注意事项
(1)蛋白提取整个过程都在冰上操作,减少高温造成的蛋白降解;超声过程中最好不要有气泡产生,减少蛋白降解,裂解后的总蛋白放在-20℃保存。
(2)制备GST融合蛋白时,应选择合适的载体和诱导条件以获得高质量的可溶性融合蛋白。
(3)在进行蛋白的诱导表达时,可溶性表达温度很重要。当温度过高,载体易形成包涵体,若复性不顺利,蛋白没有活性,会影响后续的实验。故建议进行一个诱导温度的摸索,常见的诱导温度在16℃~25℃。
(4)两种并不互作的DNA结合蛋白可能会因为DNA的存在而出现相互作用的假阳性结果,因此,在进行GST pull-down实验时,加入核酸酶的步骤十分必要。
(5)虽然大多数情况下不会造成影响,但GST标签仍可能会影响蛋白的正确折叠。如果对融合蛋白进行质量控制,会使实验结果更加可信。例如加入核磁共振、X射线晶体分析等方法验证蛋白结构有无变化;通过结合已知互作蛋白验证蛋白功能有无变化等。
最新动态
-
12.03
【干货】全方位解析GST Pull-down实验
-
12.03
【干货】一分钟解锁基因调控的秘密 — 转录因子与靶基因预测
-
11.15
【干货】手把手教你做酵母双杂交点对点验证
-
11.14
酵母双杂交点对点验证怎么做?及常见问题回答
-
11.13
酵母双杂交建库-试剂盒操作流程解析及常见问题解答
-
10.17
一文了解 | 酵母双杂交建库原理及流程
-
10.14
盘一盘 诺奖明星-micro RNA的前世今生
-
09.30
干货图文| 双荧光素酶报告基因结果解读
-
09.23
中药的现代诠释:外泌体如何革新传统医学?
-
09.10
【客户文献分享】SGLT2 抑制剂达格列净可改善高尿酸血症性肾病的肾脏纤维化










