转染siRNA秘籍:高效实验成功的关键步骤解析
siRNA(小干扰RNA,Small interfering RNA)转染实验是现代分子生物学研究中的一项重要技术,它基于RNA干扰(RNA interference, RNAi)原理,通过导入特定的siRNA分子来靶向并沉默特定的基因表达。这一技术不仅为基因功能研究提供了强有力的工具,还在疾病治疗、药物筛选及遗传性疾病治疗等领域展现出广阔的应用前景。
一、RNA干扰机制
RNA干扰是一种广泛存在于生物体内的序列特异性基因转录后沉默过程。当siRNA进入细胞后,它们会被胞质中的核酸内切酶Dicer进一步裂解成更小的片段,随后与体内蛋白结合形成RNA诱导的沉默复合物(RNA-induced silencing complex, RISC)。RISC具有切割mRNA的能力,它能够在siRNA的引导下,特异性地识别并切割靶基因的mRNA,从而阻断该基因的表达。这一过程被称为转录后基因沉默机制。
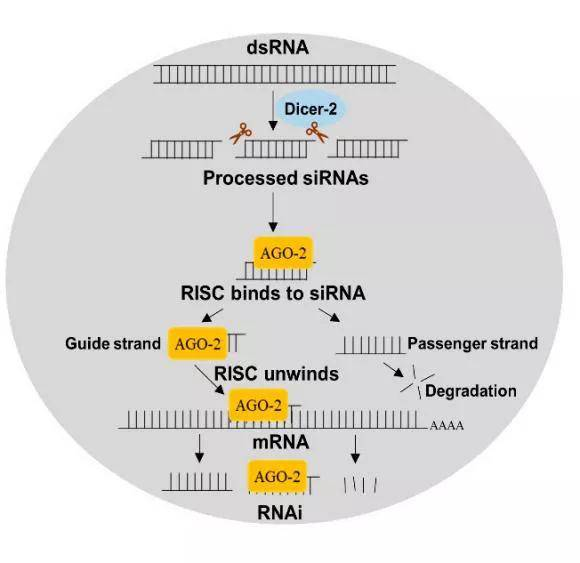
RNAi机制示意图 (Jain R G., et al. Insects, 2020.)
虽然siRNA药物在疾病治疗方面显示出巨大的潜力,但由于缺乏有效的药物递送方法,其在临床环境中的使用受到很大的限制,而siRNA转染是RNAi技术应用的瓶颈,所以siRNA转染效果是在细胞水平验证基因功能或进行基因沉默实验成功的关键过程。
二、如何实现siRNA高效转染
实现siRNA的高效转染,需要关注以下几个方面?
01.细胞准备
细胞状态:选用生理状态良好的细胞进行转染,健康的细胞转染效率较高。
细胞密度:在转染前一天接种细胞,确保细胞密度在第二天转染时达到70%~80%(不同转染试剂对密度要求不一样)。铺板时要将细胞消化完全并均匀铺板,避免细胞堆积生长。
02.转染试剂与siRNA的配制
siRNA纯化:为了提高转染效率,siRNA的浓度和纯度非常重要,推荐使用PAGE胶纯化等方法获得高纯度的siRNA。
避免RNA酶污染:由于RNA酶普遍存在于实验环境中,因此应确保实验中的每个环节不受RNA酶污染,以保证siRNA的完整性。
转染试剂选择:针对siRNA制备方法以及靶细胞类型的不同,选择合适的转染试剂。常用的转染试剂如Lipofectamine 2000、Lipofectamine 3000和RNAiMAX等,具有不同的转染效率和细胞毒性,应根据实验需求进行选择。比如:Lipofectamine 3000适用于各种难以转染的以及常见的细胞类型,对细胞作用温和,毒性低,适用于DNA、RNA和共转染。Lipofectamine RNeasy Max转染试剂:主要供siRNA和Stealth RNeasy双链体转染使用,具有转染效率高、对细胞毒性小等优点。
转染试剂配制:siRNA和转染试剂应分别用无血清无双抗的培养基(如Opti-MEM)进行稀释,并混合形成转染复合物。在配制过程中,应避免粗暴操作,以免导致脂质体失效。
03.转染操作
转染前换液:在转染前更换细胞培养基为无血清无双抗的培养基。
加入转染复合物:将配制好的转染复合物轻轻加入细胞培养板中,并轻轻摇晃使之混合均匀。
转染后换液:由于助转染试剂具有一定细胞毒性,需要在转染后4~8小时内及时换液,将无血清培养基更换为完全培养基。但需注意,不同转染试剂的换液时间可能有所不同,应根据试剂说明书和实验经验进行调整。
04.转染效率验证与优化
设置对照:为了客观地判断RNA干扰的效果,实验时必须设置阴性对照。通常的做法是把siRNA序列顺序打乱,重新排列,作为阴性对照;也可以选择不和任何基因匹配的无关序列作为对照。
荧光标记:使用荧光标记的siRNA可以分析siRNA的稳定性和转染效率。标记的siRNA还可用作siRNA胞内定位及双标记实验来追踪转染过程中导入了siRNA的细胞。
优化条件:通过实验找到最佳转染条件,包括脂质体与siRNA的比例、细胞密度、转染时间和培养基中血清的含量等。此外,还可以尝试不同的转染试剂浓度和体积来优化转染效率。
05.转染流程
下列步骤以24孔板为例,所有试剂用量和体积均是按每孔计算。
贴壁细胞:转染前一日,每孔0.5-2.0×105个细胞接种于500µL含抗生素的培养基中,转染时细胞长至70%融合最佳。
(1)转染复合物的制备
a)稀释转染试剂:使用前,将转染试剂放置于室温中,轻轻混匀,然后在无菌管中加入50µL无血清培养基或OPTI-MEM,再加入2µL转染试剂,用移液器轻轻混匀,室温静置5min;
b)稀释siRNA:在另一无菌管中加入50µL无血清培养基或OPTI-MEM,并添加2µL siRNA,用移液器轻轻混匀,室温静置5min;
c)将转染试剂/培养基混合物滴加至siRNA培养基混合物中,用移液器轻轻混匀,室温静置15~20min。
注:稀释好的转染试剂如果长时间放置可能导致转染试剂活性的降低,应尽量30min之内与稀释好的 siRNA 混和。
(2)转染过程
a)趁静置时,给24孔板换液,每孔换上400µL预热的新鲜培养基;
b)将 100µL转染复合物加入孔中,终体系为500µL,加完后将板轻轻晃动以使复合物均匀分布;
c)37℃静置培养细胞,4 -6h换成完全培养基。24-72 h检测mRNA表达,48-96 h检测蛋白表达。
| 培养板 | 培养孔面积 | 接种培养液 | 稀释用培养基 |
siRNA转染 |
|
|
siRNA |
转染试剂 | ||||
| 96孔板 | 0.3 cm² | 100µL | 2×10µL |
20 pmol |
1µL |
| 24孔板 | 2.0 cm² | 500µL | 2×50µL |
40 pmol |
2µL |
| 12孔板 | 4.0 cm² | 1mL | 2×100µL |
80 pmol |
4µL |
| 6孔板 | 10.0 cm² | 2mL | 2×200µL |
150 pmol |
7.5µL |
| 60mm | 20.0 cm² | 5mL | 2×0.5mL |
300 pmol |
15µL |
| 10cm | 60.0 cm² | 15mL | 2×1mL |
600 pmol |
30µL |
注:该方法仅供参考,具体操作流程应以转染试剂说明书为准。
三、siRNA沉默效果的评估方法
siRNA 转染细胞后,会诱发宿主细胞中的mRNA发生降解, 从而抑制了细胞内目的基因蛋白的表达,我们可以从三个方面开始验证siRNA实验转染效果。
◆mRNA水平检测
siRNA的作用机理在于其引起靶基因mRNA的降解,通过检测mRNA的降解水平可以验证siRNA的沉默效率。通常,在转染后24~48小时收样,提取细胞总RNA提取,合成cDNA全长,用实时荧光定量PCR(qRT-PCR)等方法检测进行检测。由于细胞种类、作用基因表达情况的不同,各实验最佳检测时间也不相同,检测时间过晚可能导致检测不到干扰效果。
◆蛋白水平检测
siRNA干扰也会影响靶蛋白的表达,可以通过Western blot等方法检测靶基因蛋白的表达水平,可以进一步验证siRNA的沉默效果。通常,在转染后48~72小时收样进行检测,(由于蛋白表达受到影响因素较多,如检测蛋白水平变化不明显请检测其mRNA水平变化情况,确定siRNA是否起作用)。
◆细胞表型观察
观察转染后细胞的表型变化(如细胞增殖、凋亡、迁移等),可以间接评估siRNA的沉默效果,这种方法需要结合具体的实验目的和细胞类型进行分析。
图源:https://www.gene-quantification.de/si-rna-index.html
四、注意事项
◆转染常见注意事项
1、无论您用什么转染试剂,转染时尽量不要加血清,血清里面的小分子会与siRNA竞争性进入细胞,会影响转染效率,也有说血清里含有RNA酶,会将siRNA给降解掉。
2、转染后一般推荐8-12h换液,这时可以加血清与正常培养细胞一样。
3、转染前应根据细胞种类、生长速度等因素决定转染时的细胞密度。推荐细胞密度在60%-80%时进行转染实验,细胞密度过低将影响检测结果。siRNA会随着细胞增殖降低在细胞内的浓度。例如:转染时细胞密度50%,转染效率达到100%,siRNA的有效率也100%,36h后细胞长满平皿进行检测,最后提的总RNA沉默效率可能只有50-60%。细胞密度过大,如超过90%,也会影响转染效率且后期细胞会由于密度过大生长情况受到影响无法得到理想实验结果。
◆转染后实验结果检测注意事项
1、siRNA进入细胞后还要进行解链,反义链寻找结合位点,经过酶剪切再将目的RNA降解。建议转染完换液后24-36h提总RNA,做qRT-PCR检测,48-72h提蛋白做WB检测。普通的siRNA进入细胞后能维持沉默效果大概1-3天。加化学修饰的siRNA能维持2-5天。
2、因为RNAi实验是直接作用与mRNA的,所以我们只能保证mRNA水平有效,不能保证蛋白水平有效。我们遇到过mRNA水平下调,蛋白水平没有变化的例子。
3、目的基因ΔCt与管家基因如GAPDHΔCt值相差在15以内才适合做RNAi实验。如基因本身表达量很低,效果往往不会太理想。
4、正常实验组应该有①空白组(什么都不加的);②只加转染试剂的组;③NC组;④siRNA组;⑤阳性对照组。理想的结果是①②③组的数据应该相同,或者差别不大。
a)如果NC组与空白组比下调超过50%说明NC起作用了,说明NC毒性大。这时应该降低siRNA和NC的用量。降低用量后,下调还是明显,就要换一个NC试一试。
b)如果②与①比下调明显,说明转染试剂毒性太大,需要更换转染试剂。
5、我们推荐 RT-PCR 的引物应该设计在 target 位置的两侧,而不是同侧。目前已经知道的 siRNA 介导的基因 knockdown 机制是 RSIC 先介导靶 mRNA 的切割,切割导致靶 mRNA 的降解,由于切割和降解可能具有不同的时间点,因此,设计于同侧的 PCR 引物可能导致假阴性结果或 knockdown 效率的低估。另外,RT-PCR 结果会因为靶基因 mRNA 降解时间不同、细胞内靶基因 mRNA 丰度不同而导致假阴性结果,特别对于丰度较高的基因,推荐使用的检测方式包括PCR、Northern 检测、Western 检测等。这些方法会更加真实的反映 RNAi 的结果。
最新动态
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!
-
03.20
双荧光酶数据分析指南!!!
-
03.20
【合作文献分享】双剑合璧!外泌体研究新成果揭示癌症治疗新方向










