【合作文献分享】双剑合璧!外泌体研究新成果揭示癌症治疗新方向
外泌体——这颗生命科学领域的“明星分子”,正以惊人的速度改写疾病治疗的未来!我司合作发表的两篇重磅研究-卵巢癌外泌体动态调控机制 & 何首乌外泌体抗肝癌机制,分别在《Journal of Ovarian Research》和《Heliyon: An Open Access Journal》期刊上亮相。从动物细胞到中药植物,从动态调控到跨界抗肿瘤,两大研究突破如何为癌症治疗提供新思路?让我们一探究竟!
合作文章一
01.文献背景与创新突破
本文题为《Dynamic and functional analyses of exosomal miRNAs regulating cellular microenvironment of ovarian cancer cells》,聚焦于卵巢癌(Ovarian Cancer, OC)细胞分泌的外泌体miRNA如何动态调控肿瘤微环境。作者证明了卵巢癌细胞分泌的外泌体miRNA可能在细胞间通信和动态重塑肿瘤微环境中至关重要。这些见解可以增强我们对外泌体miRNA在癌症生物学中的作用的理解,并为新型治疗策略的发展提供信息。
✨创新突破:首次通过时间序列分析(12h-48h),揭示卵巢癌细胞外泌体miRNA的动态变化规律,发现15种核心miRNA通过调控TOR、Wnt等信号通路重塑肿瘤微环境。
✨科学价值:为卵巢癌的时序性治疗策略提供靶点,助力开发“分阶段精准干预”方案。

02.主要研究思路
(1)卵巢癌外泌体:动态调控的“时间密码”
首次系统研究了卵巢癌细胞(SKOV3)在不同时间点(12、24、36、48小时)分泌外泌体miRNA的时序变化,揭示了miRNA表达的动态特征。例如,T24组(24小时)特异性miRNA数量最多(57个),提示此时细胞可能通过外泌体传递关键信号分子。

图1.来自不同培养时间点的卵巢癌细胞外泌体的表征
(2)昼夜节律基因的关联
发现外泌体miRNA可能调控昼夜节律(Circadian Rhythm, CR)相关基因(如Clock、Bmal1、Per2、Cry1),并通过Western blot验证这些基因在不同时间点的表达差异,这为肿瘤生物学与昼夜节律的交叉研究提供了新视角。

图2. 通过miRNA测序鉴定外泌体miRNA
(3)功能富集分析的深度
通过GO和KEGG分析,揭示了外泌体miRNA靶基因富集于癌症信号通路(如mTOR、PI3K-Akt、MAPK通路)和昼夜节律通路(hsa04710),为miRNA调控肿瘤进展提供了分子机制层面的证据。

图3. 特定miRNA的靶基因的功能分析
(4)miRNA与靶基因的功能验证
通过双荧光素酶报告实验验证了miR-320a-3p与DEC2基因的相互作用,表明外泌体miRNA可直接调控靶基因表达,进一步支持其生物学功能。为卵巢癌的时序性治疗策略提供靶点,助力开发“分阶段精准干预”方案。
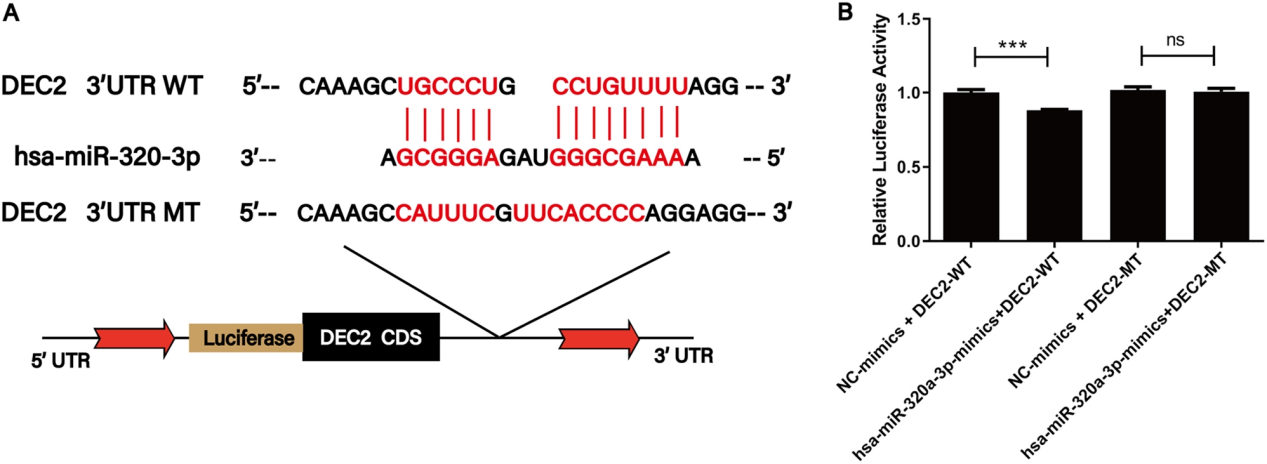
图4:外部miR-320a-3p与其潜在靶基因(DEC2)之间的相互作用通过双荧光素酶活性测定验证。DEC2,在软骨细胞蛋白2中差异表达;*** p <0.001
本研究通过时间动态分析、多组学整合和功能验证,系统揭示了卵巢癌外泌体miRNA的调控网络,为理解肿瘤微环境重塑提供了新视角。将miRNA动态分泌与昼夜节律机制关联,为开发时序依赖性治疗策略奠定了基础。
合作文章二
01.文献背景与创新突破
本文题为《Molecular anti-tumorigenic mechanism of Radix PolygoniMultiflori-derived exosome-like nanoparticles》本研究首次从传统中药何首乌(Radix Polygoni Multiflori, RPM)的汁液中分离出外泌体样纳米颗粒(ELNs),并证实其具有显著的抗肝癌活性。此前,植物ELNs的研究多集中于柠檬、山药、苦瓜等,而RPM作为具有悠久药用历史的中药,其ELNs的分离与功能探索填补了该领域的空白。
✨创新突破:全球首次从何首乌中分离出外泌体样纳米颗粒(ELNs),证实其通过调控细胞周期基因(如Cdkn1a、Cdc20)显著抑制肝癌细胞增殖与迁移,体内靶向富集于肝脏!
✨科学价值:开创何首乌“中药-外泌体”跨界抗肿瘤新模式,为天然药物开发提供全新载体。
02.主要研究思路
(1)首次从何首乌(RPM)中分离ELNs
通过差异离心和超速离心将ELN分离并从新鲜RPM汁液中提取ELNs。此方法避免了化学试剂的干扰,保留了ELNs的天然生物活性。通过对外泌体进行鉴定,发现RPM-ELNs平均粒径159.5 nm(NTA分析),符合外泌体典型的粒径大小范围,而且具有明显的杯状结构。除此之外泌体PKH26染色实验证明,RPM-ELNs可以被细胞有效吸收。

图1. 源自RPM的外泌体样纳米颗粒(ELN)的表征和细胞内在化
(2)多维度验证抗肿瘤机制
通过体外细胞实验(增殖、凋亡、迁移抑制)结合增殖抑制:CCK-8实验显示,RPM-ELNs(10⁹ particles/mL)处理24-72小时后,SMMC-7721肝癌细胞活力显著下降(图2A-B)。克隆形成实验显示ELNs显著减少细胞克隆形成数量(图2C-D),表明其长期抑制肿瘤细胞增殖的能力。流式细胞术显示,ELNs处理组早期凋亡(Annexin V+)和晚期凋亡(PI+)细胞比例显著升高(图2E-F)。
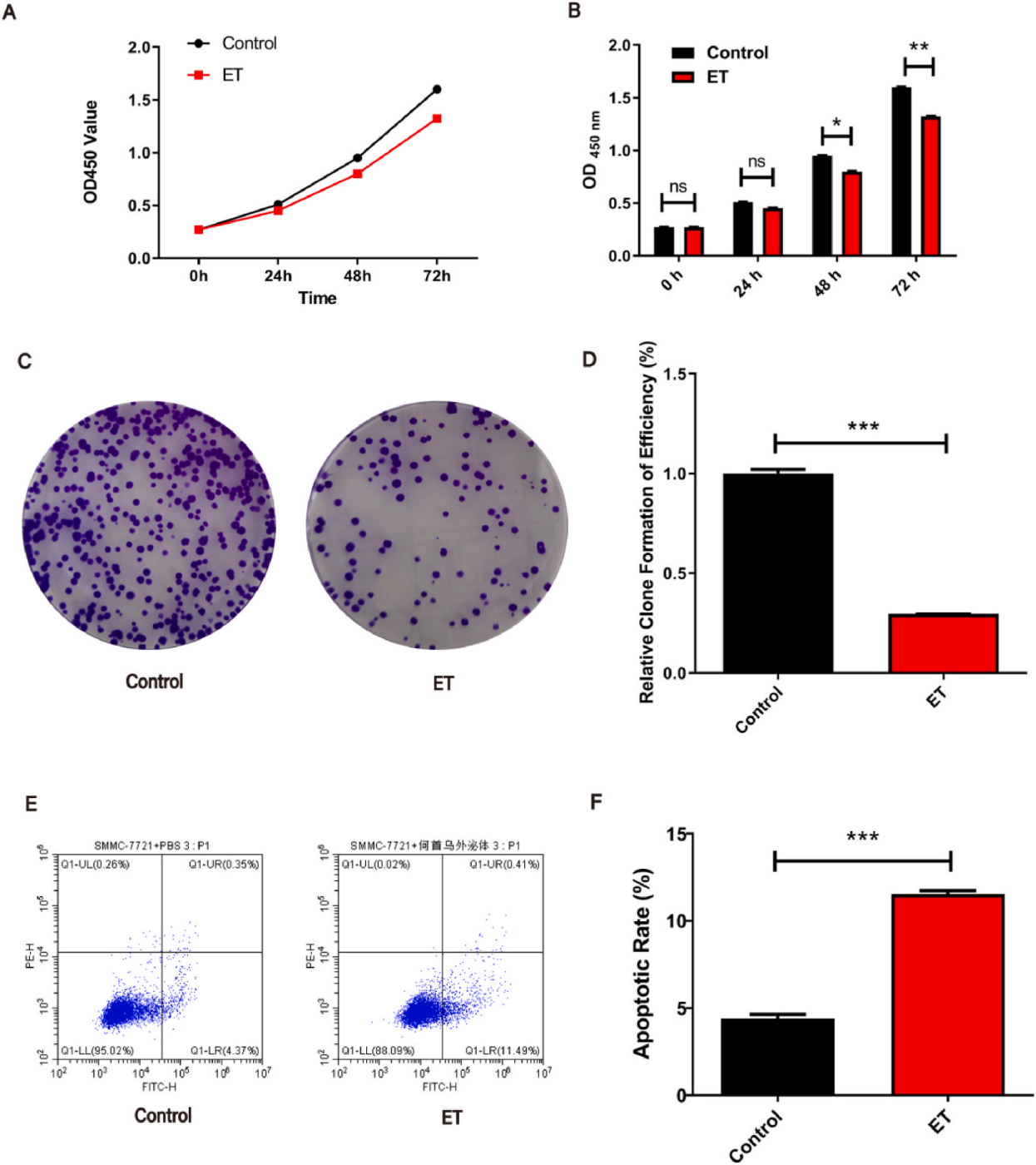
图2.RPM-ELNs调节SMMC-7721细胞的增殖和凋亡
(3)分子机制解析
RNA测序(RNA-seq)和生物信息学分析,系统揭示了RPM-ELNs通过调控细胞周期相关基因(如Cdkn1a、Cdc20)和信号通路(如HIF-1、FoxO)发挥抗肿瘤作用的分子机制。这种“表型-基因-通路”的多层次研究模式,为天然产物抗肿瘤机制解析提供了范式。
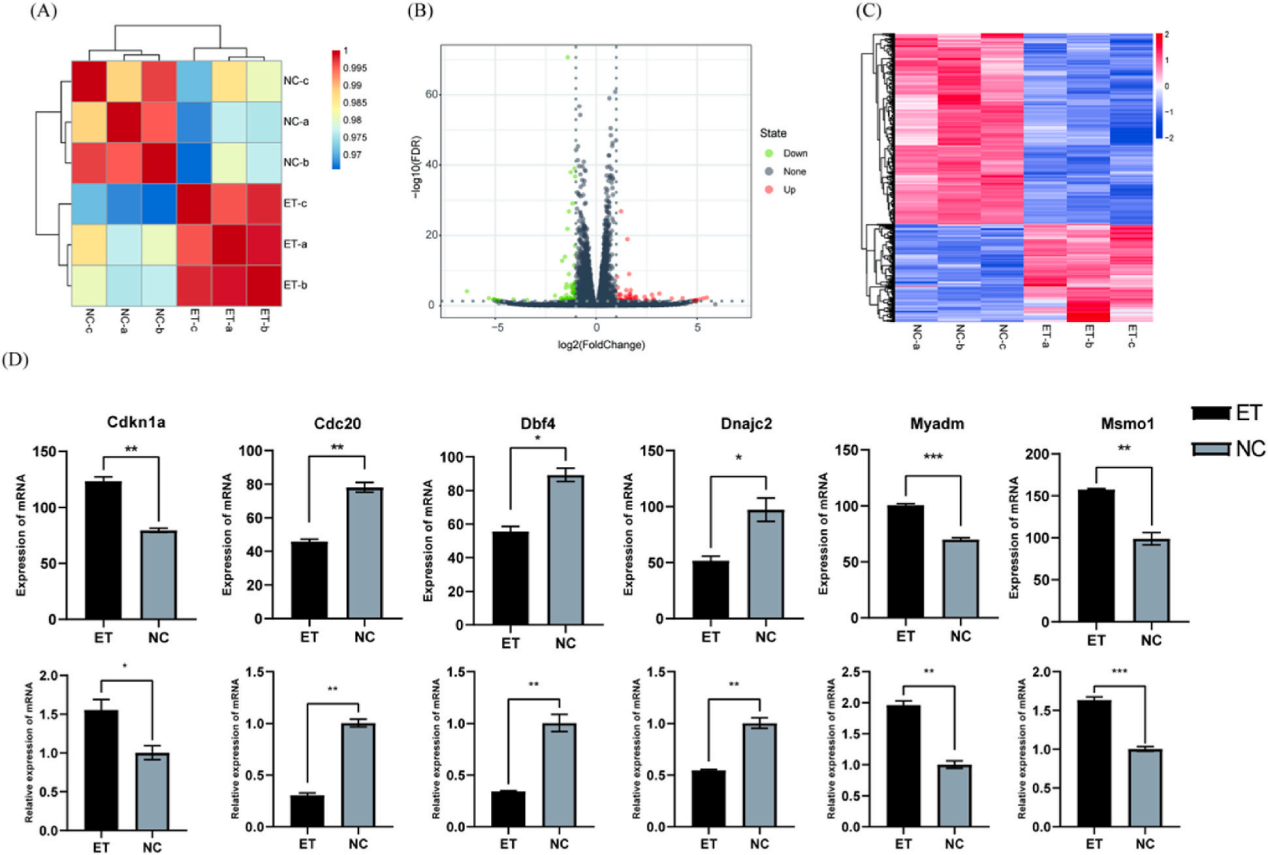
图3.RPM-ELNs的抗癌机制的分析
(4)体内靶向性验证
通过外泌体体内示踪实验,发现RPM-ELNs在小鼠体内主要富集于肝脏,其次是脾脏和肺脏,证明了何首乌外泌体具有天然肝靶向性。这一特性可能归因于肝脏网状内皮系统对纳米颗粒的主动摄取,或ELNs表面特定蛋白(如整合素)与肝细胞受体的相互作用,该发现为后续开发肝癌特异性纳米药物提供了重要依据。
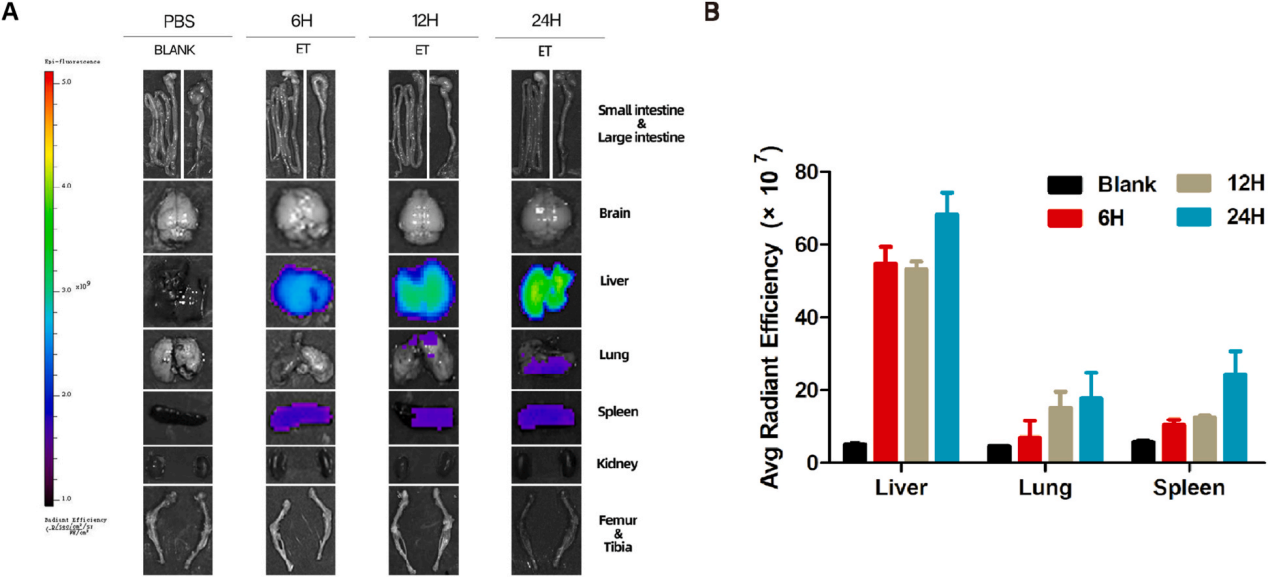
图4.小鼠RPM-ELNs的生物分布图像
本研究首次揭示了何首乌来源ELNs的抗肝癌活性及其分子机制,融合了传统中药与现代纳米技术,为肝癌治疗提供了新型天然纳米药物候选。其创新性在于从“天然产物分离-功能验证-机制解析-靶向性探索”的全链条研究模式,兼具基础科学与转化医学价值。未来研究可进一步优化ELNs的工程化修饰,提升其靶向性与疗效,推动临床前开发。
如果您正在探索:外泌体的提取和鉴定,癌症机制研究中的外泌体动态调控;植物来源外泌体的功能验证;外泌体生物标志物的筛选,请及时联系我们,获取免费技术咨询或定制方案设计!让我们以“纳米级智慧”,助您抢占科研与产业化的制高点!
参考文献:
[1]Wang Z, Huang Y, He S, Zhou Y, Zhao L, Wang F. Dynamic and functional analyses of exosomal miRNAs regulating cellular microenvironment of ovarian cancer cells. J Ovarian Res. 2025 Feb 10;18(1):25.
[2]Mingqing Yanga ∙ Lining Xub ∙ Weiyu Wang. Molecular anti-tumorigenic mechanism of Radix Polygoni Multiflori-derived exosome-like nanoparticles. Heliyon, Volume 11, Issue 4, e41918.
最新动态
-
04.14
Int J Mol Sci | 植物性外泌体样纳米囊泡治疗早期骨关节炎的分离、表征和体外细胞研究
-
04.14
RNA pull down技术实验的应用场景
-
04.03
RIP技术如何破解RNA蛋白密码?
-
04.03
Food & Function:食用菌纳米囊泡突破-泌阳花菇提取物展现惊人辐射防护力
-
03.27
J. Adv. Res.|植物源性细胞外囊泡治疗IBD:多机制作用与药物载体潜力
-
03.27
植物外泌体:解锁中药未来的 “纳米密码”
-
03.20
细胞内的"GPS"追踪术:揭秘蛋白亚细胞定位的奥秘
-
03.20
BiFC技术,让蛋白互作“看得见”!
-
03.20
双荧光酶数据分析指南!!!
-
03.20
【合作文献分享】双剑合璧!外泌体研究新成果揭示癌症治疗新方向










