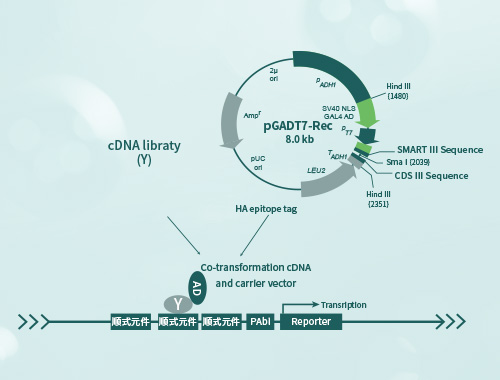
酵母单杂交
- 酵母单杂
- 高通量筛选
- 假阳性率低
服务特色
酵母单杂交(Yeast One-Hybrid)是一种用于研究蛋白质与DNA序列之间相互作用的实验技术。它结合了酵母细胞内的转录激活和检测系统,用于筛选和鉴定与给定DNA序列相互作用的蛋白质,具有高通量筛选、生理相关性、较低的假阳性率、定量分析能力以及适用于多个研究领域的优势。
服务介绍
酵母单杂交技术是在酵母双杂基础上发展而来的一种研究核酸-蛋白相互作用的工具,被广泛用于研究真核细胞内基因的表达调控,如鉴别DNA结合位点发现潜在的结合蛋白基因、分析DNA结合结构域信息等。
服务优势
- 一站式辅助检测手段方便快捷,得到可靠的实验结论;
- 多年文库构建经验,4种优化的Total RNA提取技术方案可以有效保证Total RNA的纯度和完整性,保证样本的多样性;
- 可同时研究多个蛋白质相互作用,实现高通量筛选和分析,快速获得大量相互作用信息;
- 采用多个筛选步骤,如报告基因的验证和双重选择,减少非特异性相互作用的误报。
客户提供
1、物种信息,样本类型
2、基因序列信息
3、实验目的
最终交付
- 文库菌液,文库质粒
- 高通量蛋白质组学分析(GO及KEGG功能注释)
- 原始数据及结果图片
服务说明
服务流程
酵母单杂交文库筛选
酵⺟杂交⽂库构建:
酵母杂交验证:
其他流程
| 服务项目 |
客户提供 |
最终交付 |
| 文库构建 | 组织/细胞 |
滴度在1×10°cfu/mL以上的酵母文库菌液;文库PCR鉴定结果图片(阳性率在90%以上) |
| 文库筛选 |
promoter基因序列/质粒 |
筛选过程中的全部原始图片;筛选获得所有相互作用的猎物蛋白的测序结果 |
针对酵母单杂交实验结果,可作进一步验证:
| 服务内容 |
实验目的 |
细分 | 周期(工作日) |
| EMSA | 验证启动子和蛋白互作 |
探针合成及标记 |
10 |
|
EMSA实验 |
20 | ||
| 双荧光素酶检测 | 验证启动子和蛋白互作 | 10-15 | |
| 25 |
案例展示

相关技术服务
| ▶ 双荧光素酶报告系统 | ▶ EMSA | ▶ CO-IP |
| ▶ RNA pull-down | ▶ RIP-qPCR | ▶ DNA pull-down |
| ▶ ChIP-qPCR | ▶ 酵母双杂交 | ▶ CUT&Tag |
相关资源
一、酵母单杂交技术具体的应用领域:
● 转录因子研究:酵母单杂交可用于研究转录因子与DNA序列的特异性结合。通过构建诱饵包含启动子或增强子序列,并与猎物中的转录因子相互作用,可以鉴定和验证转录因子-基因调控序列的相互作用关系。
● DNA结合蛋白鉴定:酵母单杂交可用于鉴定与特定DNA序列相互作用的蛋白质。通过构建诱饵包含DNA结合序列,与猎物中的蛋白质相互作用,可以筛选和验证与该DNA序列特异性结合的蛋白质。
● 蛋白质相互作用网络:通过酵母单杂交技术可以筛选和鉴定蛋白质间的相互作用关系,从而构建蛋白质相互作用网络。这有助于了解细胞内蛋白质相互作用的调控机制、信号传导途径和细胞过程的调节。
● 疾病相关蛋白质研究:酵母单杂交可用于研究与疾病相关的蛋白质相互作用。通过构建诱饵包含疾病相关基因的序列,与猎物中的蛋白质相互作用,可以鉴定潜在的疾病相关蛋白质相互作用伙伴。
● 药物筛选和靶点鉴定:酵母单杂交可用于筛选和鉴定与小分子化合物相互作用的蛋白质。通过将小分子化合物作为诱饵,与猎物中的蛋白质相互作用,可以评估潜在药物的靶点和相互作用机制。
二、当酵母单杂交技术与其他实验方法结合使用时,可以提供更全面和深入的研究结果。以下是一些常见的与酵母单杂交技术联用的实验方法和其应用举例:
● 免疫共沉淀(Co-Immunoprecipitation,Co-IP):通过与酵母单杂交技术联用,可以验证蛋白质相互作用的存在并进一步分析相互作用的性质。例如,在酵母单杂交实验中筛选出与诱饵相互作用的猎物后,可以使用Co-IP方法来验证这些相互作用是否发生在真实的细胞环境中。
● 质谱分析(Mass Spectrometry,MS):与酵母单杂交联用的质谱分析可用于鉴定与诱饵相互作用的蛋白质。通过将与诱饵相互作用的蛋白质从酵母细胞中纯化并用质谱分析鉴定,可以确定相互作用蛋白的身份。
● 染色质免疫沉淀(Chromatin Immunoprecipitation,ChIP):酵母单杂交结合ChIP技术可以用于研究转录因子与DNA的相互作用,并确定特定DNA区域的转录因子结合位点。通过将转录因子与GST融合,并使用酵母单杂交筛选出与GST-融合转录因子相互作用的蛋白质,然后使用ChIP技术来鉴定这些蛋白质在基因组上的结合位点。
● 荧光共振能量转移(Fluorescence Resonance Energy Transfer,FRET):酵母单杂交与FRET技术联用可以用于直接检测蛋白质-蛋白质相互作用的发生。通过将诱饵和猎物蛋白质分别标记为供体和受体荧光染料,当两者相互作用时,可以通过FRET信号的变化来确认相互作用的发生。
● 三维染色质构象分析:酵母单杂交技术与染色质构象分析方法(如3C、4C、5C、Hi-C等)联用,可以研究蛋白质与染色质之间的相互作用对染色质三维结构的影响。通过将与特定染色质区域相互作用的蛋白质进行酵母单杂交筛选,然后使用染色质构象分析方法来探索蛋白质与染色质之间的联系。
三、常见问题与解析
1、什么是均一化和三框文库,对文库质量有什么影响?金开瑞对三框文库是如何处理的?
▶ 均一化cDNA文库:是指某一特定组织或细胞的所有表达基因均包含其中,且在cDNA文库中表达基因对应的cDNA的拷贝数相等或接近。减少冗余转录物的拷贝而增加低丰度转录物的拷贝而构建的cDNA文库。简单说就是降低高峰度的核酸,这样低峰度核酸就会占比高一些。均一化cDNA文库是克服基因转录水平上巨大差异给文库的筛选和分析带来障碍的有效措施,有利于研究基因的表达和分析。现在,在构建均一化cDNA文库中至少有两种主要的观点。一种是基于复性动力学的原理,高丰度的cDNA在退火下复性速度快,而低丰度的cDNA复性要很长时间,从而可以通过控制复性时间来降低丰度;另一种是基于基因组DNA在拷贝数上具有相对均一化的性质,通过cDNA和DNA的饱和杂交而降低在文库中高拷贝存在的cDNA的丰度。
▶ 三框文库:氨基酸对应三个密码子,文库中CDNA的片段大小是随机的,读码框也是随机的,例如ATG,有可能是从A开始翻译,也有可能是从T或G开始翻译,这种情况下就只会出现一个正确的读码,如果客户感兴趣的基因恰好移码了,这样就会提前终止,筛选也不可能被筛出来。三框通过人为的引入一个和两个碱基,使每个移码的基因都能正确的被读出来。
▶ 金开瑞三框文库:传统的三框文库均是通过引物的方式人为引入突变的,金开瑞采用载体改造的方式在载体上引入三个不同的读码框突变。这样的三框文库构建只用合成一份双链cDNA,cDNA的合成纯化均是在同样的反应条件下进行的,可以完全保证三框文库的片段长度,文库滴度等信息的完全一致性,减少三框文库的差异对筛选结果的影响。
2、如果诱饵可以直接激活报告基因,该如何处理?
为保证诱饵蛋白功能的完整性,首先我们会考虑用3'AT/ABA进行背景抑制,但是由于这两种试剂对酵母生长具有较大的毒性,后续可能会影响文库筛选,因此在3'AT超过15mM,ABA超过1200ng/ml时我们会考虑将诱饵蛋白进行截断,通过查阅文献和相关数据库,截去转录激活的区域,需要注意的是,截去的这一部分很有可能会影响到互作结果。
3、酵母诱饵该选择全长还是核心区域?
(1)全长:
优点:更接近于自然条件下的环境;
缺点:有时候过于长,导致构建具有一定的难度,更可能的产生自激活现象。
(2)预测的核心元件(<20bp):
优点:核心元件用于后续的EMSA验证试验,对核心位点进行突变验证启动效果是否减弱,相对全长启动子而言突变的区域较少操作更为方便;
缺点:核心元件虽然是启动的核心区域,但是启动子的其他区域也可能是作为辅助元件而存在的,如果缺少这些部分就是非自然条件下的环境,可能产生假阴性。
(3)蛋白结构功能域:
优点:能准确的研究出这部分区域是否在全长中行使重要的功能,为同一类型的功能研究具有重要的意义;
缺点:不确定其他功能域是否与它一起行使其他功能,或者需要二者之间的搭配才能行使某一项功能,可能会产生假阴性。
4、酵母杂交发生假阳性的原因及解决方式
产生原因:
(1)由于BD融合诱饵蛋白有单独激活作用,或者其激活作用被外来蛋白激活。
(2)AD融合靶蛋白如果有DNA的特异性结合,也可以单独激活报告基因的表达。
(3)BD和AD在文库中会有随机碰撞导致空间上的接近,以致下游报告基因的表达。
解决方法:
(1)对于点对点验证来说,可同时将诱饵和猎物进行自激活验证,减少假阳性的判定,但是一旦诱饵和猎物均产生自激活,后续自激活的处理方式(截短)会浪费较多的时间;(我们一般不采取这种解决方式)
(2)由于每个报告基因上游的调控区各不相同,因此用不同的报告基因验证阳性,可用于排除或减少假阳性;(我们主要采用这种解决方式)
(3)单杂启动子,我们主要采用将报告基因整合到酵母的染色体上,可以使基因表达水平文档,消除了由于质粒拷贝数变化引起的基因表达水平的波动而造成的假阳性。










